| Corrélations électromyographique du sommeil chez le Chat décortiqué et mésencéphalique chronique |
| Par M. Jouvet et F. Michel Extrait
des Comptes rendus des séances de l'Académie des Sciences, Séance du 25 Mai 1959. - Tome CLIII, n° 3, 1959, p. 422 |
On sait depuis Goltz (1*) que l'animal décortiqué est capable de sommeil. Les travaux de Bard (2*) ont également démontré que l'animal mésencéphalique ou "pontique" chronique présentait des variations de vigilance. Dans des travaux antérieurs [Jouvet et coll. (3*)], nous avions montré que, chez des animaux décortiqués ou mésencéphaliques, l'activité électrique méso-diencéphalique ne subissait aucune variation selon les états de vigilance. C'est pourquoi nous avons été amenés à explorer l'activité des formations rhombencéphaliques, à la recherche d'une activité particulière accompagnant le sommeil. Chez certains animaux, surtout l'animal mésencéphalique chronique, l'objectivation du sommeil est chose difficile : c'est pourquoi plus qu'au comportement postural de l'animal, plus qu'aux variations du rythme respiratoire, c'est aux variations électromyographiques que nous nous sommes adressés : parmi celles-ci, c'est l'E.M.G. des muscles de la nuque qui nous est apparu comme étant, chez le Chat, l'index le plus sûr du sommeil.
Matériel et méthodes
Cette étude porte sur 10 animaux décortiqués totaux et subtotaux, implantés selon les méthodes décrites antérieurement [M. Jouvet et coll. (3*, 4*)] et 10 animaux porteurs de section totale ou subtotale à la limite antérieure du mésencéphale.
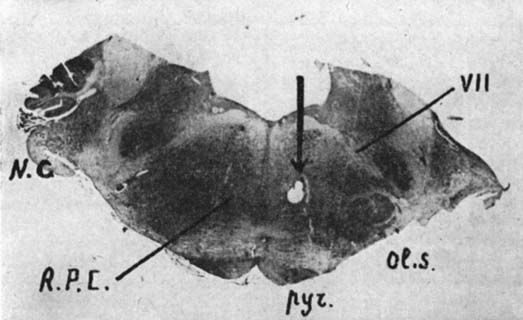
L'électrode rhombencéphalique est mise en place au niveau du nucleus reticularis pontis caudalis (fig. 3). Une électrode bipolaire souple est fixée directement sur les muscles de la nuque. Le placement des électrodes, l'étendue des lésions ont toujours été vérifiés histologiquement.
Résultats
I - ANIMAL DÉCORTIQUÉ TOTAL.
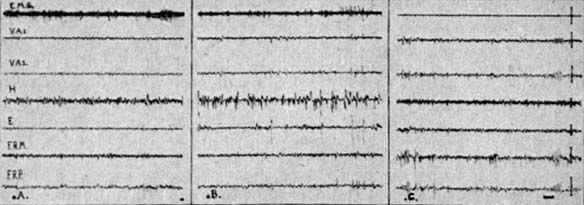
Au cours de l'endormissement et du sommeil profond les formations centrales rhomboméso-diencéphaliques présentent continuellement une activité rapide, identique à celle observée au cours de l'état de veille : tandis qu'au niveau du rhinencéphale apparaissent des pointes brèves, l'activité E.M.G. est modérée (fig. 1 B). Cette phase est suivie d'une "phase paradoxale" dont l'activité est extrêmement caractéristique. Cette phase est brève, sa durée au cours d'une période de sommeil ne dépasse pas une dizaine de minutes et il est rare de l'observer plus de quatre ou cinq fois au cours d'observation continue de 6 heures.
Elle est marquée par l'apparition de bouffées d'activité rythmique de fuseaux à 6 c/sec, de grande amplitude, se répétant de façon régulière au niveau de la formation réticulée pontique. En même temps que s'installe cette activité deux ordres de phénomènes apparaissent :
a) d'une part, une activation rhinencéphalique (activité rapide), tandis que les formations mésodiencéphaliques continuent à rester rapides, bien que parfois des " fuseaux " y apparaissent ;
b) d'autre part, une disparition totale de toute activité tonique musculaire (fig. 1 B).
L'observation de l'animal montre qu'à ce stade les membranes nictitantes recouvrent presque entièrement le globe oculaire dont les pupilles sont en myosis extrême et qu'il existe des petits mouvements très rapides des vibrisses. Si l'on réveille l'animal à ce stade, on voit alors disparaître l'activité de spindles (fig. 1 A) et réapparaître l'activité musculaire.
ANIMAL DÉCORTIQUÉ SUBTOTAL
Il suffit de respecter une très minime surface de néocortex pour retrouver, au cours des deux premières phases du sommeil, l'invasion des formations méso-diencéphaliques par des fuseaux et des ondes lentes. Le "stade paradoxal" s'objective de la même façon que précédemment décrit : apparition de "fuseaux" pontiques mais, cette fois, les formations méso-diencéphaliques redeviennent rapides ainsi que la surface corticale restante. Une stimulation auditive, de moyenne intensité. entraîne soit le retour aux deux phases précédentes du sommeil, soit le réveil de l'animal.
L'injection intrapéritonèale de nembutal permet de retrouver de façon fugace la phase paradoxale au cours de la période d'activité rapide rhinencéphalique. Dès qu'apparaissent les pointes brèves et de grande amplitude hippocampiques traduisant la narcose profonde [Jouvet et coll. (5*)], l'activité pontique devient rapide.
II. ANIMAL MÉSENCÉPHALIQUE.
L'activité électrique des formations corticales et diencéphaliques, situées en avant de la section, présentent continuellement l'aspect classique du cerveau isolé [Bremer (6*)], encore que de brèves et indiscutables phases d'activation apparaissent au niveau du cortex lors de stimulations olfactives.
Fig. 1. - Animal décortiqué chronique
A Veille. B : Sommeil profond, stade des Pointes rhinencéphaliques. C Stade paradoxal, stade des fuseaux pontiques.
E.M.G. : muscle de la nuque -,. VA 1-2 ventral antérieur thalamus H hippocampe E : aire entorrhinale ; FRM : formation réticulée mésencéphalique ; FRP formation réticulée pontique,; A1-A2 : amygdale.
Calibrage : 1 sec ; 50 microvolts.
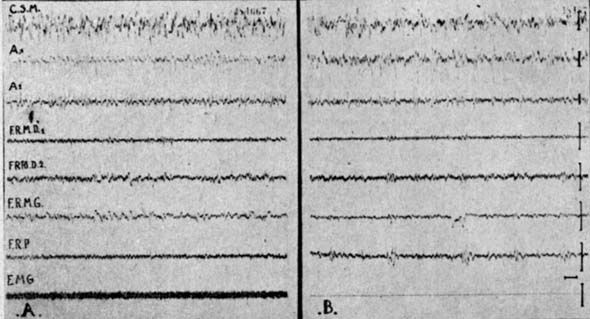
L'activité rhinencéphalique est représentée par des pointes de forte amplitude (fig. 2 A. B.). En arrière de la section, l'activité mésencéphalique reste constamment rapide (fig. 2 A. B.). Seule peut s'objectiver la phase "paradoxale" qui correspond, selon nous, au "sommeil" de l'animal mésencéphalique : fuseaux pontiques, absence totale d'activité E.M.G. (fig. 2 B).
Si la section du tronc n'est pas totale et qu'il persiste une mince lame de tissu cérébral central reliant les étages méso- et diencéphalique, les deux premiers stades décrits sur l'animal normal se retrouvent et le stade paradoxal s'accompagne alors d'une activation mésodiencéphalo-corticale et rhinencéphalique.
Discussion
L'absence d'activité lente sous corticale au cours des deux premières phases du sommeil physiologique chez l'animal décortiqué total conduit évidemment à incriminer le néocortex comme responsable de l'inhibition active s'exerçant sur le système réticulaire ascendant au cours de cette période.
La mise en évidence de cette inhibition télencéphalique nécessite des conditions d'observations chroniques, car ce phénomène n'a pas été remarqué par Kennard (7*) sur le singe décortiqué en expérience aiguë et n'a été qu'inconstamment signalé par Morison et coll. (8*) au niveau du thalamus chez le chat décortiqué, toujours en expérience aiguë.
Fig. 2. - Animal mésencéphalique chronique
A - Veille. B : Stade de sommeil, fuseaux pontiques. E.M.G. : muscle de la nuque ; VA 1-2 ventral antérieur thalamus ; H hippocampe E : aire entorrhinale ; FRM : formation réticulée entorrhinale; FRP : formation réticulée pontique ; A1-A2 : amygdale Calibrage : 1 sec, 50 µvolts.
A côté de cette inhibition corticifuge, il faut également supposer la mise en jeu, lors de la phase paradoxale, d'un mécanisme inhibiteur situé au niveau du pont. Cette activité n'est pas d'origine sus-jacente puisqu'elle s'observe aussi chez l'animal mésencéphalique. Sa topographie semble recouvrir en partie celle de la formation réticulée facilitatrice descendante [Magoun et Rhines (9*)]. On serait donc conduit à assimiler la disparition totale de toute activité musculaire tonique à une inhibition de cette structure.
On doit ainsi au cours du sommeil physiologique, distinguer deux phases bien différentes :
1) la première est d'origine télencéphalique ; c'est elle qui est responsable de l'inhibition envahissant le système activateur ascendant chez l'animal normal ou décortiqué subtotal ou à section incomplète du tronc, réalisant un véritable état, de "léthargie de l'encéphale", avec cependant persistance d'une légère activité, tonique musculaire ;
2) la seconde, dont la mise en jeu est encore imprécise, est d'origine rhombencéphalique. Elle entraîne les phénomènes somatiques du sommeil à leur maximum et s'accompagne d'une activation sus-jacente, selon des mécanismes qui restent encore à être précisés (*).
Fig. 3. - Position de l'électrode au niveau de la formation réticulée pontique (animal mésencéphalique chronique)
NC : noyau cochléaire ; NPC : nucleus reticularis pontis caudalis ; Pyr pyramides ; Ol.S. : olive supérieure.
(1*) F. Goltz, Arch. f. il. ges. Physiol., 1892, t. 51,
p. 570.
(2*) M. B. Macht et P. Bard, Fed. Proc., 1942, t. 1, p.
56.
(3*) M. Jouvet et F. Michel, C. R. Soc. Biol., 1958, t.
152, p. 1167.
(4*) M. Jouvet, F. Michel et J. Courjon, Soc. E.E.G.,
Paris, Nov. 1958.
(5*) M. Jouvet, F. Michel et J. Courjon. C. R. Soc. Biol.,
1959, t. 153, p. 101.
(6*) F. Bremer, C. R. Soc. Diol., 1936, t. 122, p. 464.
(7*) M. A. Kennard, J. Neurophysiol., 1943, t. 6, p. 233.
(8*) R. S. Morison et D. L. Bassette, J. Neurophysiol.,
1945, t. 8, p. 309.
(9*) H. W. Magoun et R. Rhines, Spasticity, Springfield,
Thomas.
(Institut de Physiologie [Directeur : M. H. Hermann], Faculté de Médecine et de Pharmacie, Lyon).
(*) Les recherches rapportées dans cet article ont été l'objet d'une subvention partielle de l'Office of Scientific Research of the Air Research and Development Command, United States Air Force, attribuée par son service européen, sous contrat A. F. 61 (514) 1206.