| Étude de la motricité oculaire au cours de la phase paradoxale du sommeil chez le chat |
| M. Jeannerod, J. Mouret et M. Jouvet Electroencephalogr. Clin. Neurophysiol. 18 pp : 554-566 (1965) |
Décrits d'abord chez l'homme au cours de la phase du sommeil avec activité corticale rapide (Aserinski et Kleitman 1953, 1955) (voir Bibliographie in Dement 1964), les mouvements rapides des yeux (MRY) au cours du sommeil semblent avoir une relation étroite avec l'imagerie visuelle onirique (Dement et Kleitman 1957).
Constatés et enregistrés ensuite chez le chat normal (Dement 1958; Jouvet et al. 1959; Jeannerod et Mouret 1963a; Berlucchi et al. 1964), les M RY constituent l'un des indices comportementaux les plus fidèles de l'état de sommeil avec activité corticale rapide (activated sleep, Dement 1958) et abolition de l'activité électrique des muscles de la nuque (phase rhombencéphalique ou paradoxale du sommeil: PP de Jouvet et al. 1959). Ces mouvements ont été ensuite constatés chez des préparations décortiquées ou mésencéphaliques au cours de la PP (Jouvet 1962, 1965).
L'étude des mécanismes des MRY présente donc un double intérêt: d'une part leur mise en jeu concomitante avec la PP peut permettre de mieux comprendre les mécanismes de cet état de sommeil, d'autre part la relation de ces MRY avec l'imagerie onirique constitue l'une des meilleures voies d'approche objectives du problème psychophysiologique des rêves. Cependant, l'allure, le nombre et la répartition de ces MRY n'ont fait jusque là l'objet d'aucune étude comparée. Leur complexité nous a conduits d'abord à un essai d'analyse quantitative et comparative avec les mouvements oculaires de l'éveil. La recherche des structures responsables de leur déclenchement nous a incités ensuite à étudier les variations de leurs indices chez diverses préparations chroniques, et à aborder ainsi leurs possibles mécanismes. Ce travail a fait l'objet de notes préliminaires (Jeannerod et Mouret 1963a; 1963b; Jeannerod et al. 1964; Mouret et al. 1964).
Matériels et méthodes
Cette étude porte sur 30 chats adultes opérés et implantés aseptiquement sous anesthésie au Nembutal. Les électrodes corticales sont de fines vis en acier inoxydable fixées à travers l'os au contact de la dure-mère. Les électrodes souscorticales, implantées stéréotaxiquement, sont constituées de fils d'acier inoxydable tressés dont les surfaces de section sont distantes de 1 mm. Des électrodes souples en acier sont placées au niveau des muscles de la nuque.
Des électrodes vissées de part et d'autre de chaque orbite enregistrent les variations du champ électrique dues à la mobilisation du dipôle cornéo-rétinien (Kris 1958), objectivant ainsi les mouvements oculaires. Certains animaux ont subi l'ablation des membranes nictitantes.
Les chats sont enregistrés dans une cage vitrée et insonorisée, suffisamment vaste pour que l'animal puisse prendre sa position préférée, et maintenue à température de 20°-30°.
Pendant l'éveil, les mouvements des yeux sont enregistrés pendant l'observation visuelle. L'animal, soit libre, soit la tête fixée à un support, est alors soumis à un spectacle standardisé (taches lumineuses mouvantes, souris blanche, etc. ).
Au cours des états de sommeil lent ou rapide (Fig. 1), les yeux sont observés à travers les paupières qui s'entr'ouvrent spontanément ou sont maintenues ouvertes par des bandes de sparadrap. Ainsi les variations du diamètre pupillaire peuvent également être observées.
Le tracé oculographique, ainsi que les dérivations corticales et sous-corticales, l'EMG de la nuque et le rythme cardiaque, sont enregistrés sur un appareil EEG à plumes REEGA VIII ALVAR. Les mouvements oculaires sont enregistrés avec une constante de temps courte: 0,1 sec, et un gain de 4 mm/50 microV. L'activité EEG est enregistrée avec une constante de temps identique.
Dans un deuxième temps, après une semaine de tracés de contrôle quotidiens, diverses lésions ont été pratiquées sous anesthésie au Nembutal.
1. Décortication totale (2 chats) réalisée en un seul temps par section avec une large spatule, puis aspiration du neocortex restant, le cortex piriforme et l'hippocampe ventral étant en majeure partie respectés.
2. Décortication occipItal.e (2 chats): la lésion bilatérale, pratiquée en un seul temps, s'étend à l'aire visuelle primaire et secondaire (aires 17, 18 et 19 ou gyrus lateralis posterior medialis, et suprasylvius posterior et medialis) .
3. Décortication frontale (3 chats): la lésion est pratiquée par section frontale des deux hémisphères au moyen d'une lame, en avant de la suture coronale. Le sinus longitudinal supérieur est respecté. Dans deux cas, les pôles frontaux sectionnés ont été laissés en place, et aspirés dans l'autre cas.
4. La décérébration (5 chats) est réalisée par voie intercolliculaire: le tronc cérébral est totalement sectionné au moyen d'une lame et le cerveau antérieur à la section est aspiré, à l'exception d'un îlot hypothalamique qui reste séparé du tronc par une lame en résine acrylique (Jouvet et al. 1963). L'animal est ensuite placé dans une couveuse artificielle permettant une survie prolongée (plus de deux mois).
5. Coagulation des colliculi supérieurs (2 chats). Chaque colliculus est détruit au moyen d'un courant continu de 5 mA.
Après une survie moyenne de 1 mois, au cours de laquelle des enregistrements quotidiens sont effectués, les animaux sont sacrifiés sous narcose au Nembutal, puis perfusés de formol intracarotidien. Les cerveaux sont ensuite colorés suivant les techniques du bleu de Nissl, de Loyez et de luxol fast blue.
Résultats
I. Les mouvements des yeux chez l'animal normal
A. Description.
Les mouvements oculaires constituent le plus remarquable des phénomènes phasiques survenant sur le fond d'atonie musculaire de la PP. Leurs caractéristiques permettent de les distinguer très nettement des mouvements oculaires d'éveil: en effet, alors que ces derniers sont bien individualisés, rarement groupés, en relation étroite avec les éléments du champ visuel, les mouvements de PP ont un aspect anarchique: sur le tracé électro-oculographique (EOG) (Fig. 2) ce sont des déflexions d'amplitude variable, le plus souvent groupées, pouvant réaliser de véritables "bouffées" de mouvements prenant parfois un aspect nystagmiforme. On peut aussi observer des mouvements isolés, assez comparables à ceux de l'éveil bien que souvent monoculaires (mouvements non conjugués) (Berlucchi et Strata 1965). Entre les mouvements se situent des pauses: les yeux sont alors soit en position intermédiaire, soit plus rarement en "déviation" tonique latérale. Cette pause tonique peut n'intéresser qu'un seul oeil qui regagne ensuite la position conjuguée par un glissement lent, comme l'ont observé également Berlucchi et al. (1964). Au cours de la PP, on peut aussi noter d'autres phénomènes oculaires: les paupières sont entr'ouvertes, les membranes nictitantes sont relâchées. La pupille est en myosis très serré, mais parfois sujette à de brusques mydriases, en particulier au cours bouffées de mouvements (Berlucchi et al. 1964; Hodes 1964).
B. Essai d'analyse quantitative.
(1) Les mouvements isolés: Sur des enregistrements pris à grande vitesse (6 cm/sec) il est possible de calculer la vitesse de chaque mouvement isolé sous la forme approchée de la "pente". Le calcul exact de la vitesse angulaire nécessiterait en effet la connaissance du rapport entre la déviation angulaire des yeux et la déflexion sur le tracé, ce qui est difficilement réalisable chez le chat. Nous avons donc été amenés à caractériser chaque mouvement par sa durée (T msec) et son amplitude ou déflexion (D mm) qui reste relativement constante. Les valeurs moyennes des rapports D/T établies pour 600 mouvements isolés d'observation et de PP sont les suivants:
Observation: D/T = 1.98 +- 0.04
PP : D/T = 1.81 +- 0.02
La comparaison de ces résultats au moyen du test t du Student donne une valeur de t = 6.1. Il apparaît ainsi que les mouvements isolés au cours de la PP ont une pente légèrement inférieure à ceux de l'observation.
(2) Groupement. Nous appelons "groupe de mouvements" toute succession de déplacements oculaires tels qu'il n'y ait entre eux aucune pause ni en position intermédiaire ni dans aucune autre position. Les tracés étant pris avec une constante de 0.1 sec, les groupes sont alors caractérisés par la disparition de la ligne de base de l'électrooculogramme (Fig. 2).
Nous distinguons ainsi à la suite des mouvements isolés, les petits groupes (2-4 mouvements) qui peuvent également se voir au cours de l'observation et les "bouffées" (groupes de 5 mouvements et plus) rencontrées spécifiquement au cours de la PP.
L'étude de la répartition des mouvements des yeux au cours de la PP nous amenés à définir les indices suivants:
(a) L'indice numérique global (ING): fréquence des mouvements (quel qu'en soit le type) par minute de PP. Le calcul de cet indice pendant 360 min de PP chez 10 chats normaux donne les résultats suivants: ING=78.2 +-18.05
(b) L'indice de groupement (IG): fréquence des bouffées (5 mouvements et plus) par minute de PP: IG = 4.12+-1.27.
(c) La constante de répartition oculomotrice (CROM): c'est le rapport entre le nombre de mouvements compris dans les bouffées (5 mouvements groupés et plus) et le nombre total de mouvements d'une PP. Cette valeur est exprimée en pourcentage. Elle reste constante non seulement chez un même animal, mais d'un animal à l'autre, quels que soient le nombre total de mouvements, le nombre de bouffées, la durée de la PP. Les résultats portant sur plus de 10,000 mouvements au cours des PP sont les suivants: mouvements totaux: 11,697; bouffées (5 mouvements et plus): 5,814; CROM: 49.7% +- 3.37. Cette répartition des mouvements oculaires pendant la PP, pour moitié en mouvements isolés ou peu groupés et pour moitié en groupes complexes spécifiques de la PP nous est apparue comme une caractéristique remarquable de l'activité oculaire du sommeil.
C'est donc à l'aide de ces trois indices que nous avons pu étudier de façon quantitative les structures et les mécanismes responsables de ces mouvements chez diverses préparations chroniques. Malgré la stabilité de la CROM, nous avons cependant toujours étudié chaque préparation en deux temps: contrôle chez L'animal normal, puis variation des indices après lésion.
Tableau I
Variation des différents indices des MRY au cours du sommeil paradoxal chez des chats avant et 30 jours après la lésion: décérébration pré-pontique, coagulation des colliculi supérieurs, décortication occipItal.e, décortication totale, décortication frontale
| Pontique | Coll. sup. | Décort. vis. | Décort. totale | Décort. front. | |||||||||||
| ING | IG | CROM | ING | IG | CROM | ING | IG | CROM | ING | IG | CROM | ING | IG | CROM | |
| Contrôle | 70 | 4 | 50,5 | 75 | 3,8 | 49,3 | 72,1 | 3,8 | 50 | 89 | 4,4 | 48,4 | 78,2 | 4,12 | 49,7 |
| 1 Mois après lésion | 26 | 0,3 | 7,5 | 54,9 | 2,3 | 33,5 | 50 | 1,1 | 26,7 | 74,6 | 4,8 | 58,8 | 136 | 5,2 | 74 |
Légende pour les Tableaux I et II :
ING : Indice Numérique Global.
IG : :Indice de Groupement.
CROM : Constante de Répartition Oculo-Motrice.
Résultats
II. Analyse des mouvements des yeux après différentes lésions
(Voir Tableau I)
A. Section du tronc cérébral: animal pontique (Fig. 3, B et 4, B). Chez le chat pontique chronique, les mouvements des yeux sont totalement absents au cours de l'éveil. Les PP, d'une durée moyenne de 6 min, surviennent à intervalles très réguliers et sont caractérisées par la disparition de la rigidité de décérébration, par une activité de pointes monophasiques au niveau de la formation réticulée pontique et par la présence de petites secousses des pattes et des oreilles (Jouvet 1962). Il existe une diminution considérable du nombre total des mouvements et de la CROM par rapport au chat normal car les mouvements oculaires sont rares, uniquement latéraux, externes et le plus souvent isolés.
B. Coagulation des colliculi supérieurs (Fig. 3, C et 4, C). Les mouvements des yeux sont rares au cours de l'éveil, ce qui s'explique par l'importance du colliculus supérieur chez le chat sur le plan perceptif (Blake 1959). Les PP surviennent de façon régulière mais les MRY sont moins fréquents et le nombre de bouffées diminue.
C. Décortication occipItal.e (Fig. 3, D et 4, D). Au cours de l'éveil, le comportement oculaire est caractéristique: rareté des mouvements et reconnaissance purement olfactive des objets (souris, nourriture, etc.). Pendant la PP, l'analyse des indices révèle également une diminution des MRY et des bouffées.
D. Animal totalement néodécortiqué (Fig. 3, E et 4, E). Cette préparation est caractérisée pendant l'éveil par l'absence totale de mouvements oculaires. Au cours des PP, la répartition oculomotrice est très particulière: au début, les premiers mouvements sont isolés et peu amples, puis ils se groupent rapidement pour donner des bouffées stéréotypées de 6-8 mouvements séparées par des intervalles réguliers. Mais cette préparation est aussi capable de réaliser des groupes beaucoup plus complexes. L'étude des indices fait ressortir une augmentation notable de la CROM (Fig. 3, E).
E. Animal décortiqué frontal (Fig. 3, F et 5). Pendant l'éveil, le clignement à la menace est aboli. Alors que chez l'un (PY 1), les mouvements oculaires au cours de l'observation paraissent normaux, chez l'autre (SY 1), il existe une véritable "fixation spasmodique", le regard pouvant être entraîné dans toutes les directions sans habituation. Il en résulte une augmentation considérable du nombre des mouvements oculaires pendant l'éveil (Fig. 5, A).
Pendant la PP, cette augmentation importante est retrouvée chez les deux chats: les mouvements sont pratiquement toujours groupés en bouffées souvent très complexes (plus de 50 mouvements se succédant sans pause (Fig. 5, B)).
Résultats
III. Modifications par les agents pharmacodynamiques
La constatation au cours de la PP de bradycardie, de variations respiratoires, de myosis, et de relâchement de la membrane nictitante associés à l'action inhibitrice de l'atropine, avait fait soulever l'hypothèse d'un mécanisme de type cholinergique (Jouvet 1962). C'est pourquoi nous avons étudié l'action d'agents anticholinergiques et anticholinesterasiques sur les mouvements oculaires du chat normal et après lésion. Nos résultats sont calculés au cours des PP enregistrées au cours de la première heure qui suit l'injection.
1. Action de l'atropine. L'atropine, à la dose moyenne de 1.5 mg/kg supprimant l'apparition des PP, il est nécessaire pour déclencher celle-ci de faire précéder l'injection d'atropine de l'administration de gamma-butyrolactone, à la dose de 50 mg/kg (Jouvet et al. 1961b). Cette dernière drogue, utilisée isolément, ne modifie pas l'activité oculaire pendant la PP. Dans ces conditions, les résultats sont les suivants chez le chat normal:
Chat LY 1:
Normal: ING : 86 - IG : 4.6 - CROM: 51.2
Atropine: ING : 21.5 - IG : 0.8 - CROM: 63.2
L'élévation paradoxale de la CROM sous l'influence de l'atropine alors que l'lndice Numérique Global et l'lndice de Groupement sont considérablement diminués s'explique par le fait que les mouvements, bien qu'ils se produisent rarement, sont surtout groupés et qu'il y en a peu d'isolés. Nous n'avons pu étudier l'action de l'atropine sur les MRY que chez le chat normal. En effet, l'action inhibitrice de cette drogue sur le déclenchement des PP est tellement importante chez les diverses préparations opérées que nous n'avons pas pu obtenir de PP de façon régulière, même après l'injection préalable de gammabutyrolactone.
2. Action de l'ésérine (Fig. 6) (Tableau II).
(a) Chez l'animal normal: à la dose de 0.0250-050 mg/kg (par voie intra-péritonéale) l'ésérine ne modifie pas le comportement du chat éveillé dont les mouvements oculaires d'observation restent normaux. Le rythme d'apparition des PP n'est pas modifié: par contre, les mouvements oculaires sont surtout groupés, ce qui se traduit par une élévation importante de la CROM (Fig. 6, A).
(b) Chez l'animal pontique: l'injection d'ésérine ne modifie pas la répartition des mouvements oculaires (Fig. 6, E).
(c) Chez l'animal totalement décortiqué: l'ésérine entraîne au contraire une augmentation de tous les indices et en particulier de la CROM qui est déjà élevée chez cette préparation (Fig. 6, B).
(d) Chez l'animal dont les colliculi supérieurs sont détruits l'action facilitatrice est également notable (Fig. 6, C).
TABLEAU II
Indices de la motricité oculaire au cours de la PP, avant et après injection intrapéritonéale de 0.025 mg de sulfate de physostigmine (ésérine) chez les différentes préparations
| Contrôle | Après ésérine | |||||
| ING | IG | CROM % | ING | IG | CROM % | |
| Normal | 72.1 | 4 | 50 | 64.9 | 4.5 | 60.2 |
| Pontique | 26 | 0.3 | 7.5 | 28 | 0.3 | 8 |
| Décort. totale | 74.6 | 4.8 | 58.8 | 91.9 | 6.7 | 66.8 |
| Abl. coll. sup. | 63 | 2.1 | 27.6 | 77 | 3 | 43.5 |
| Décort. vis. | 50 | 1.1 | 26.7 | 53 | 2 | 29 |
Discussion
A. Il est tout d'abord nécessaire de marquer les limitations de la méthode électro-oculographique que nous avons employée car les indices que nous avons adoptés sont basés sur l'enregistrement EOG avec une constante de temps courte (0.1 sec); d'ailleurs l'enregistrement en courant continu (que nous n'avons pu pratiquer) ne présenterait pas d'avantages particuliers car la méthode comparative fait appel à la variation relative des indices en fonction des diverses préparations plus qu'à leur valeur absolue.
B. Les différences entre MRY d'observation et de PP apparaissent nettement à la lumière de nos différents résultats. La différence des pentes des mouvements isolés d'éveil et de PP, bien que significative, est peu importante. Par contre trois séries de résultats permettent de différencier formellement les mécanismes d'apparition des MRY de la PP de ceux de l'état vigil. Le mode de groupement en bouffées n'existe pas chez l'animal normal éveillé qui, même lorsque l'on stimule fortement son attention, se désintéresse rapidement de l'environnement. Des mouvements des yeux très complexes continuent à apparaître au cours de la PP chez des préparations totalement incapables de MY au cours de l'éveil (chat décortiqué ou pontique). Ces données sont comparables à celles qui ont été obtenues chez des chatons nouveau-nés (Jouvet et al. 1961a; Berlucchi et Strata 1965; Valatx et al. 1964) et qui révèlent que les MRY apparaissent au cours de la PP une dizaine de jours avant l'ouverture des yeux et les mouvements oculaires d'éveil. Enfin, l'ésérine qui ne modifie pas les MY d'éveil a une action facilitatrice notable sur les MRY de sommeil du chat normal.
C. Structures responsables des MRY de sommeil
1. Chez le chat pontique chronique, dont un minimum de structure oculomotrice est respecté (noyau du VI), les MRY persistent au cours des PP bien que peu fréquents et presque uniquement isolés latéraux et externes ou en petits groupes, alors qu'ils sont totalement absents au cours de "l'éveil". La partie caudale du tronc cérébral apparaît donc suffisante à la mise en jeu des MRY au cours de la PP. Certains résultats permettent de penser que la région pontique jouerait un rôle déterminant: en effet, la stimulation, chez le chat décérébré, de la région située en avant du noyau du VI peut entraîner des mouvements des yeux (Faulkner et Hyde 1958). Sans qu'il existe à ce niveau un véritable "centre" des mouvements latéraux (centre parabducens) (Crosby 1953; Carpenter et al. 1963) il existe néanmoins une zone responsable de ces mouvements sous la dépendance de structures susjacentes. Les noyaux vestibulaires s'y projettent également (Crosby 1953) et leur rôle dans le contrôle de l'oculomotricité a été démontré par les expériences de stimulation (Crosby 1953; Hyde et Eliasson 1957; Faulkner et Hyde 1958; Shanzer et Bender 1959), les expériences de lésion des noyaux vestibulaires (Shanzer et Bender 1959) ou de leurs connections avec les noyaux oculomoteurs (Hyde 1962). Il convient en outre de signaler que la destruction de la partie antérieure du noyau reticularis pontis caudalis supprime les MY latéraux et laisse persister les MY verticaux d'éveil. Ces lésions suppriment également l'apparition des PP (Jouvet 1962). Il apparaît ainsi probable que les structures déclenchantes de la PP et celles qui sont responsables des mouvements des yeux au cours de cet état sont situées au même niveau de la formation réticulée pontique. Nos résultats font également apparaître qu'il doit exister entre la "zone de déclenchement" pontique et le cortex des structures qui complexifient l'activité motrice oculaire de sommeil, car le chat totalement décortiqué présente des MRY beaucoup plus complexes que l'animal pontique.
2. Parmi les structures mésencéphaliques, les colliculi supérieurs semblent jouer un rôle important. Leur destruction par coagulation réduit en effet de manière importante la complexité des groupements. Cependant, la persistance, chez ces animaux, d'une CROM à 30 % laisse supposer l'intervention d'autres structures mésencéphaliques non spécifiques dont le rôle dans la motricité oculaire (pendant l'éveil) a été démontré par Szentagothai (1950). Cet auteur a obtenu des réponses motrices oculaires par stimulation du noyau de Darkschewitsch, du noyau interstitiel, de la formation réticulée mésencéphalique. De même, Faulkner et Hyde (1958) ont obtenu chez des chats décérébrés des mouvements oculaires par stimulation non seulement du colliculus supérieur mais aussi de la formation réticulée mésencéphalique, de l'aire pré-tectale, du tegmentum ventral. Par ailleurs, Szentagothai (1950), après destruction des colliculi supérieurs, a décrit des images de dégénérescence dans ces mêmes structures mésencéphaliques, tandis que les noyaux oculo-moteurs sont épargnés. Ces résultats ont trouvé par la suite une confirmation dans les travaux de Altman et Carpenter (1961). Il existe donc entre les colliculi supérieurs et les noyaux oculo-moteurs une vaste zone non spécifique en rapport avec les mouvements oculaires qui apparaît importante dans la complexification des patterns des MY de sommeil.
3. Le rôle des aires oculo-motrices corticales a fait l'objet de nombreuses études au cours de l'éveil: la stimulation électrique du lobe occipItal. (Crosby 1953, 1960; Wagman et al. 1958) entraîne des mouvements oculaires conjugués dont la direction est en rapport étroit avec la zone stimulée. Au contraire, l'ablation des lobes occipitaux abolit le nystagmus optokinétique et réduit considérablement les mouvements des yeux pendant l'éveil (Wagman et al. 1958) comme nous l'avons également constaté. La stimulation électrique de l'aire oculo-motrice frontale (aire 8) (voir références en Crosby 1953) entraîne également des déviations oculaires conjuguées. Mais la destruction bilatérale du lobe frontal augmente la réponse optokinétique du lobe occipItal. (Henderson et Crosby 1952) ce qui met en évidence le rôle dominant des centres frontaux sur les centres occipitaux (Crosby 1953). Nous avons noté le même effet après lobotomie frontale au cours de l'éveil (Fig. 5). Au cours de la PP, les rôles du cortex occipItal. et du cortex frontal apparaissent également bien distincts. La décortication occipItal.e bilatérale entraîne un effet comparable à celui de la destruction des colliculi supérieurs, c'est-à-dire une diminution de la motricité globale et de la complexité des groupements. Le cortex occipItal. apparaît ainsi jouer un rôle facilitateur sur la motricité oculaire de sommeil. Ce rôle pourrait s'exercer par l'intermédiaire des colliculi supérieurs et du mésencéphale. En effet, la destruction des aires visuelles occipItal.es entraîne des signes de dégénérescence au niveau des colliculi supérieurs (stratum griseum intermedium), des noyaux réticulaires du tegmentum mésencephalique (Walberg 1957; Beresford 1961), ainsi que dans les noyaux réticulaires du tegmentum protubérantiel, en particulier au niveau du nucleus reticularis pontis caudalis (Escobar et al. 1963). Par contre, cette destruction n'entraîne aucun signe de dégénérescence neuronale au niveau des noyaux oculo-moteurs. La décortication frontale entraîne au contraire une augmentation de tous les indices oculaires au cours de la PP et révèle ainsi le rôle inhibiteur de cette région sur la motricité oculaire du sommeil. Le problème du point d'impact de l'inhibition frontale est cependant plus difficile à résoudre: tous nos résultats permettent de penser que le colliculus supérieur joue un rôle primordial dans la constitution des groupements complexes. Si l'action inhibitrice frontale s'y exerçait par l'intermédiaire d'un relais occipItal. comme au cours de l'éveil (Von Bonin et al. 1942) un animal sans cortex visuel aurait une CROM supérieure à celle de l'animal totalement décortiqué, ce qui n'est pas le cas. Les centres frontaux semblent donc aussi agir directement sur le colliculus supérieur et la zone mésencéphalique sousjacente. Ces résultats permettent donc de concevoir, schématiquement, l'organisation d'un système oculo-moteur particulier au cours de la PP: la zone de déclenchement des MRY devrait ainsi être située au niveau du pont, tandis que les actions facilitatrice du cortex occipItal. et inhibitrice du cortex frontal s'exerceraient au niveau de la région mésencéphalique où s'opère la complexification des mouvements oculaires induits par le pont. Cette organisation est ainsi différente de celle qui est admise pour les MY d'eveil où le cortex central joue un rôle prédominant (Crosby 1960; Pasik et Pasik 1964).
D. Cette hypothèse d'une mise en jeu pontique des MRY de sommeil est également appuyée par l'étude de l'activité musculaire extrinsèque oculaire: les mouvements oculaires d'éveil ont des caractéristiques toniques qui permettent le maintien de l'oeil en position de fixation (Fig. 7, B). Par contre, les bouffées de mouvements oculaires du sommeil sont avant tout phasiques: l'enregistrement EMG des muscles extrinsèques oculaires révèle l'absence d'activité tonique de base et l'existence de brèves décharges phasiques (Michel et al. 1964b) (Fig. 7, A). Or les travaux de Hyde (1962) ont permis de dissocier les structures responsables de ces deux types de mouvements oculaires: les uns, toniques, sont déclenchés par stimulation du cortex occipItal. et nécessitent un fond postural d'origine vestibulaire; les autres, phasiques, sont déclenchés par stimulation des colliculi et peuvent être exécutés en l'absence de tonus de base. Si l'origine des mouvements oculaires isolés de la PP reste imprécise, l'origine sous-corticale des bouffées, phasiques oculaires est certaine.
E. Action des drogues. Les seules données certaines apportées par nos expériences révèlent que l'action facilitatrice de l'ésérine ne s'exerce ni au niveau de la zone de déclenchement des mouvements (puisqu'elle n'augmente pas les MRY de l'animal pontique), ni au niveau des muscles oculaires extrinsèques dont on connaît la sensibilité à l'acétylcholine (Duke-Elder and Duke-Elder 1930) car l'ésérine n'a pas d'action chez l'animal sans cortex occipItal. ni chez l'animal éveillé. L'action facilitatrice de l'ésérine chez l'animal décortiqué total oblige à admettre une action au niveau de la zone mésencéphalique. Il reste par contre difficile d'expliquer 1'absence d'action de l'ésérine chez l'animal sans cortex visuel. Il faut alors invoquer à la fois la suppression d'une zone corticale très sensible à l'acétylcholine (Krnjevic et Phillis 1963; Spehlmann 1963) et l'exagération du rôle inhibiteur du cortex frontal par cette même drogue. Les résultats obtenus avec l'atropine sont opposés à ceux obtenus avec l'ésérine (chez le chat intact) et sont donc en faveur de l'existence d'un "maillon" cholinergique au cours des MRY de la PP. D'autres expériences sont cependant nécessaires pour connaître à quel niveau s'effectue l'action inhibitrice de l'atropine.
F. Relation avec l'activité électrique cérébrale. Les MRY s'accompagnent d'une activité de pointes monophasiques (parfois groupées en pseudofuseaux) à différents niveaux. Décrite au niveau du pont (Jouvet et Michel 1959) cette activité a ensuite été retrouvée au niveau du noyau géniculé latéral (Mikiten et al. 1960, du noyau du III (Brooks et Bizzi 1963) et du cortex visuel (Mouret et al. 1963) (Fig. 8). Le rapport entre les pointes monophasiques et les MRY n'est cependant pas encore élucidé. Bien qu'il y ait une relation temporelle étroite entre les MRY et les pointes monophasiques, l'activité électrique phasique persiste après énucléation totale des 2 globes oculaires et de leur musculature extrinsèque (Michel et al. 1964a). Il ne s'agit donc pas d'une activité évoquée d'origine rétinienne ou musculaire. L'activité phasique électrique doit au contraire être interprétée comme l'expression des mécanismes neuroniques qui déclenchent les MRY. Dans cette hypothèse il est intéressant de remarquer que cette activité représente l'expression d'un système ascendant ponto-géniculé visuel puisque les pointes persistent au niveau du pont chez l'animal pontique (Jouvet 1962) et que des sections dorsales du mésencéphale suppriment les pointes géniculées et corticales en laissant persister les pointes pontiques et l'activation corticale au cours de la PP (Hobson 1965). Il apparaît ainsi probable que l'activité électrique phasique ponto-géniculée visuelle et les MRY sont l'expression d'un système ascendant qui trouve son origine à partir du pont (dans une zone voisine ou coïncidant avec celle responsable du déclenchement de la PP (Jouvet 1962)).
Résumé
1. Les mouvements rapides des yeux (MRY) survenant au cours de l'état de sommeil avec activité corticale rapide ou phase paradoxale du sommeil (PP) ont été étudiés au moyen de la méthode électro-oculographique chez des chats chroniques normaux ou porteurs de diverses lésions cérébrales.
2. Chez le chat normal, au cours de la PP, on peut distinguer des mouvements oculaires isolés, en petits groupes (comme pendant l'observation) et des bouffées (plus de 5 mouvements); ces bouffées sont spécifiques de la PP.
3. La vitesse des mouvements isolés au cours du sommeil est légèrement plus lente que celle des mouvements isolés d'observation.
4. Différents indices ont été utilisés pour analyser ces mouvements: fréquence par minute, nombre de bouffées par minute et rapport entre le nombre des mouvements compris dans les bouffées et le nombre total de mouvements. Ce rapport, ou constante de répartition oculomotrice, est constant et égale à 50 % chez chaque animal normal.
5. Chez le chat pontique, incapable de MY d'éveil, des MY, latéraux, rares et isolés, surviennent au cours des PP. Les structures suffisantes à l'apparition des mouvements oculaires de sommeil sont ainsi situées dans la partie caudale du tronc. Les arguments en faveur d'une "zone de déclenchement" pontique sont discutés.
6. Après décortication totale, les MY isolés disparaissent presque totalement, mais le nombre de bouffées augmente. Il existe donc des structures sous-corticales prépontiques susceptibles de complexifier l'activité oculo-motrice déclenchée par le pont. Parmi ces structures le colliculus supérieur joue un rôle important car sa destruction diminue les MRY.
7. La décortication occipItal.e diminue le nombre de bouffées tandis que la décortication frontale l'augmente. Il est donc permis de penser que le cortex visuel a un rôle facilitateur et le cortex frontal un rôle inhibiteur sur la motricité oculaire de la PP. Les influences corticales pourraient s'exercer directement au niveau de la région des colliculi et du mésencéphale.
8. L'action inhibitrice de l'atropine et l'action facilitatrice de l'ésérine ont été constatées. Le mode d'action central de l'ésérine est discuté.
9. Les rapports entre les MRY, l'activité musculaire extrinsèque oculaire et l'activité électrique phasique ponto-géniculée visuelle survenant au cours de la PP sont discutés.
10. L'ensemble de ces résultats suggère qu'un système oculo-moteur, à point de départ pontique, est responsable des MY de sommeil. L'organisation schématique d'un tel système est discutée.
Summary
1. The rapid eye movements (REM) occurring during the stage of sleep with fast cortical activity, or paradoxical stage of sleep (PP), have been studied by the electro-oculographic method in chronically implanted cats which were either normal or had brain lesions.
2. In the normal cat, during the PP, the eye movements are either isolated, in small groups (like during visual observation) or in bursts (more than 5 movements); these bursts are specific to the PP.
3. The speed of isolated movements during sleep is slightly slower than that of isolated movements during visual observation.
4. Some indices have been used to analyze these movements: number per minute, number of bursts per minute, and the ratio between the number of movements in bursts and the total number of movements. This ratio, the Constant of Oculomotor Repartition, remains constant at 50% in every normal animal.
5. In the pontine cat, unable to make eye movements during the waking state, lateral eye movements, rare and isolated, occur during the PP. The structures sufficient for the appearance of the eye movements of sleep are therefore situated in the caudal portion of the brain-stem. The arguments in favour of a pontine trigger zone are reviewed.
6. After total decortication the isolated REM disappear almost completely but the number of bursts increases. Thus there are prepontine, subcortical structures which complicate the oculomotor activity triggered by the pons. Among these structures, the superior colliculus plays an important role as its coagulation results in a diminution of the REM.
7. OccipItal. decortication decreases the number of bursts whereas frontal decortication increases it. It therefore seems likely that visual cortex plays a facilitatory role, and frontal cortex an inhibitory one, in ocular movement of the PP. The cortical influences might act directly at the level of the colliculus and mesencephalon.
8. The inhibitory effect of atropine and the facilitatory effect of eserine are described. The central mode of action of eserine is discussed.
9. The relationships between REM, the activity of the extraocular muscles, and the phasic ponto-geniculo-visual electrical activity occurring during PP are considered.
10. These results suggest that an oculomotor system, triggered by the pons, is responsible for the eye movements during sleep. A schematic organization of such a system is proposed.
Figure 1 : Chat normal. Enregistrement polygraphique
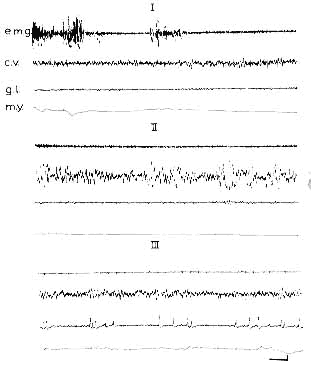
- I: éveil.
- II: sommeil lent.
- III: phase paradoxale du sommeil.
- e.m.g.: electromyogramme des muscles de la nuque.
- c.v.: enregistrement bipolaire au niveau du cortex visuel.
- g.l.: enregistrement bipolaire au niveau du géniculé latéral.
- m.y.: électro-oculogramme.
Calibrages: 1 sec, 50 microV.
Figure 2 : Electro-oculogramme du chat normal

1. A l'éveil, pendant l'observation visuelle d'un spot lumineux.
2. Au cours de la PP: on remarque une bouffée de mouvements et
des mouvements isolés.
H: mouvements horizontaux.
Figure 3 : Valeurs de la constante de répartition oculo-motrice (CROM) chez différentes préparations
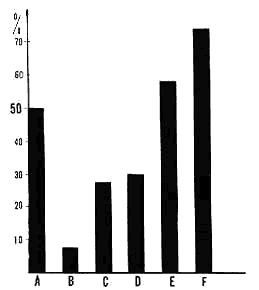
A: animal normal (où la valeur de 50% est constante).
B: animal pontique.
C: coagulation des colliculi supérieurs.
D: décortication occipItal.e.
F: décortication totale.
F: décortication frontale.
Figure 4 : Aspect électro-oculographique des MRY au cours du sommeil paradoxal chez diverses préparations (1 mois après la lésion)
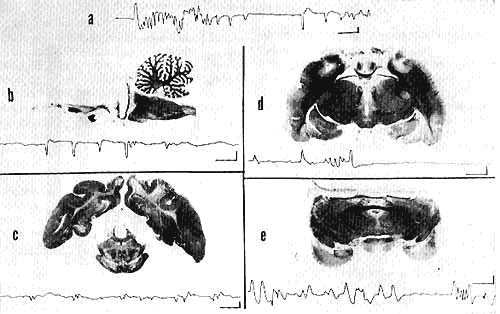
a: chat normal;
b: chat pontique;
c: après coagulation des colliculi supérieurs;
d: après décortication occipItal.e;
e: après décortication totale.
Calibrages: 1 sec, 50 microV.
Figure 5 : Leucotomie frontale (chat SY 1)
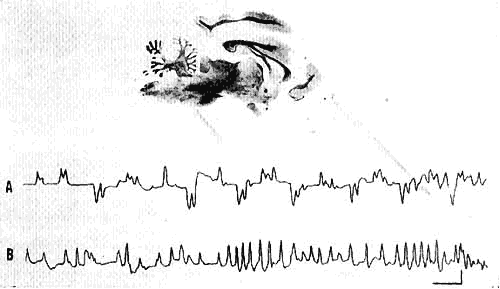
A. Mouvements oculaires horizontaux au cours de l'observation d'un pendule.
Il n'existe aucune habituation (comparer avec Fig.
2).
B. Au cours de la PP, augmentation considérable des MRY en bouffées.
Calibrages: 1 sec, 50 microV.
Figure 6 : Action de l'ésérine sur la complexité du groupement des mouvements oculaires au cours de la PP chez diverses préparations
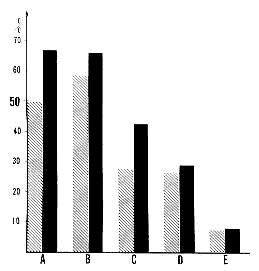
hachures: valeur de la CROM avant l'injection;
en noir: valeur de la CROM après injection d'ésérine.
A: chat normal.
B: décortication totale.
C: coagulation des colliculi supérieurs.
D: décortication occipItal.e.
E: chat ponlique.
Figure 7 : Enregistrement de l'activité des muscles extrinsèques oculaires
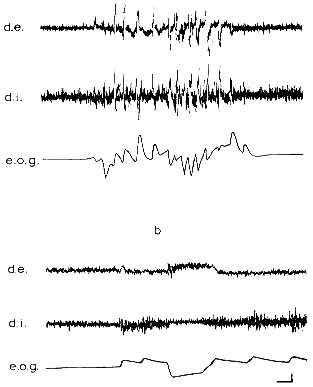
(d.e.: droit externe, d.i.: droit interne) et de l'électro-oculogramme (e.o.g.)
(a) au cours de la PP; (b) au cours de l'observation visuelle.
Calibrages: 1 sec, 50 microV.
Figure due à l'obligeance du Dr. F. Michel.
Figure 8 : Pointes monophasiques
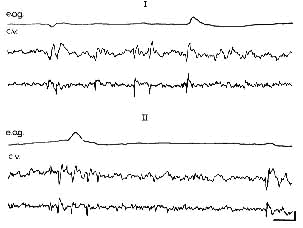
enregistrées au niveau du cortex visuel (c.v.) au cours de la PP (dérivation bipolaire). Ces pointes surviennent sur un fond d'activité rapide corticale et sont en relation avec des mouvements oculaires.
I: pointes isolées.
II: pointes groupées en pseudo-fuseaux.
e.o.g.: oculogramme des mouvements des yeux (horizontaux).
Calibrages: 1 sec, 50 microV.