| Mécanismes du cycle veille-sommeil-rêve |
| Jean Louis Valatx La Revue du Praticien (Paris) 1996; 46: 2404-10 |
Le sommeil calme à ondes lentes et le sommeil paradoxal sont, chacun, le produit du fonctionnement de deux réseaux de neurones: un réseau exécutif, assimilable à un pacemaker, responsable des signes du sommeil, et un réseau permissif contrôlant le déclenchement du sommeil. L'éveil résulte de l'activité d'une dizaine de structures redondantes. Les systèmes permissifs font partie du réseau de l'éveil. L'endormissement est la conséquence du blocage de l'éveil par un système anti-éveil synthétisant des substances hypnagogues. Ce mode de régulation permet d'appréhender les insomnies comme des troubles de l'éveil relevant d'une approche thérapeutique renouvelée.
Depuis la fin des années 1950, nous savons que le sommeil humain se déroule par cycles composés de deux états, le sommeil calme à ondes lentes (ou sommeil lent) et le sommeil paradoxal au cours duquel survient le rêve (voir article d'Alain Besset, page 2412). Cette organisation est partagée par tous les mammifères et les oiseaux, ce qui permet son étude chez l' animal.
L'état actuel des connaissances permet d'élaborer un schéma de fonctionnement assez simple malgré l'absence de fonction unanimement reconnue aux deux états de sommeil. L'évolution des théories rend compte de cette difficulté.
Du sommeil passif au sommeil actif
Pendant longtemps on a pensé que le sommeil était un phénomène passif dû à la mise au repos des centres de l'éveil (1). Cependant, les observations anatomo-cliniques de Von Economo, les expériences de stimulation déclenchant des ondes lentes et les lésions provoquant une insomnie apportent des arguments en faveur d'un phénomène actif résultant de la mise en jeu de structures nerveuses ou centres (1,2). La multiplicité des centres a conduit à la notion de système ou de réseau pour définir un circuit complexe prenant en charge une fonction.
Quant aux neuromédiateurs, dès leur localisation en 1964, par histofluorescence, leur rôle dans le sommeil a été recherché.Ainsi, est née la théorie aminergique du sommeil (3), faisant de la sérotonine l'hormone du sommeil (encadré 1).
Puis, le rôle des peptides a été suggéré à la suite de la suppression du sommeil paradoxal par le chloramphénicol, antibiotique inhibiteur de la synthèse protéique. L'étude systématique des peptides découverts dans le cerveau a permis d'établir une longue liste de substances hypnogènes (4,5). La privation de sommeil, supposée entraîner leur accumulation, a servi de modèle pour isoler d'autres substances à partir d'extraits cérébraux d'animaux privés de sommeil.
Ces deux théories (monoamines et peptides) complémentaires ne donnent qu'un aperçu partiel des mécanismes du sommeil. Nous aborderons la régulation des états de vigilance dans l'ordre de leur apparition au cours du développement ontogénétique.
Sommeil paradoxal
En effet, le sommeil paradoxal est le premier état de sommeil à apparaître au cours de l'ontogenèse (6). Un ensemble de paramètres le caractérisent. L'atonie musculaire, signe de sommeil profond, associée à l'activité corticale rapide, signe d'éveil, a fait donner à cet état, par Jouvet, le nom de phase paradoxale du sommeil. De nombreux mouvements oculaires et de discrets mouvements de la face et des extrémités des membres surviennent de façon discontinue. Ces activités phasiques sont les témoins d'une activité centrale, appelée pointes PGO car elles sont enregistrées dans les régions ponto-géniculo-occipitales (7).
Très schématiquement, le sommeil paradoxal peut être envisagé comme résultant de l'interaction de deux réseaux : le réseau exécutif, responsable des aspects phénoménologiques, et le réseau de contrôle dit permissif.
Réseau exécutif
La première description du sommeil paradoxal, réalisée chez un animal décérébré, a permis de situer d'emblée les structures responsables dans le tronc cérébral en arrière de la section 2. Pour chacun des paramètres du som meil paradoxal (SP), ont été identifiés des neurones, dits "SP-on", car leur décharge unitaire est spécifique de ce sommeil (7) (fig. 1).
L'atonie musculaire est la conséquence de l'hyperpolarisation des motoneurones spinaux par la glycine (8), neurotransmetteur inhibiteur libéré sous l'influence du tronc cérébral. La lésion des neurones situés dans le pont et le bulbe supprime la paralysie musculaire. Les conséquences fonctionnelles de cette lésion sont détaillées dans l'encadré 2.
Les pointes PGO prennent leur origine au niveau du tegmentum pontique. Ces neurones "PGO-on" sont cholinergiques et agissent sur des récepteurs nicotiniques thalamiques. Ils reçoivent des afférences excitatrices non encore identifiées et des afférences inhibitrices aminergiques.
Les mouvements des yeux et de la face sont souvent synchrones des pointes PGO. Cependant, aucune connexion anatomique n'a été mise en évidence entre les neurones "PGO-on" et les noyaux des nerfs crâniens. Ces structures reçoivent des afférences du noyau réticulé pontique caudal qui serait ainsi le générateur des activités phasiques du sommeil paradoxal. Une autre caractéristique du sommeil paradoxal de l'homme, l'érection pénienne, a été mise en évidence tout récemment chez le rat (9). Contrairement aux autres activités phasiques, le déclenchement de cette érection semble venir de l'hypothalamus antérieur.
L'activation corticale du sommeil paradoxal dépend principalement de deux structures (fig. 1) contenant des neurones soit cholinergiques, actifs pendant l'éveil et le sommeil paradoxal soit non cholinergiques, uniquement actifs pendant le sommeil paradoxal. Ces neurones se projettent de manière diffuse sur le thalamus et l'hypothalamus postérieur, relais vers le cortex.
Controle permissif
Ce réseau est constitué par les neurones dits "SP-on", aminergiques (noradrénaline, sérotonine et histamine). En s'arrêtant de fonctionner, ils lèvent I'inhibition exercée sur les neurones du système exécutif.
Le réseau exécutif comme pacemaker
Le réseau exécutif peut être assimilé à un pacemaker, c'est-à-dire fonctionnant en permanence s'il est isolé. Plusieurs arguments sont en faveur de cette interprétation.
Au cours de l'ontogenèse, la myélinisation débute dans le tronc cérébral. Le réseau du sommeil paradoxal est le seul à fonctionner et ce sommeil occupe ainsi la quasi-totalité du temps dans la seconde moitié de la gestation chez le cobaye (6), Progressivement, les systèmes permissifs deviennent matures et contrôlent son déclenchement.
Chez l'adulte, un état équivalent à celui du foetus peut être obtenu pendant quelques heures à la suite de l'injection de muscimol, agoniste GABAergique, dans l'hypothalamus postérieur ou dans la substance grise périaqueducale (10). Ainsi, les mécanismes du déclenchement du sommeil paradoxal semblent simples. La levée des différentes inhibitions s'exerçant sur les réseaux exécutifs permet à ces derniers de s'exprimer. Les systèmes permissifs contrôlent de façon très stricte le déclenchement du sommeil paradoxal et empêchent sa survenue en dehors du sommeil.
Sommeil à ondes lentes
Alors que le sommeil paradoxal est caractérisé par plusieurs paramètres facilement quantifiables, le sommeil calme à ondes lentes est défini négativement, par de nombreux auteurs, comme non REM sleep, le sommeil qui n'est pas le sommeil paradoxal. Un seul critère le définit, la présence de fuseaux et d'ondes lentes cérébrales.
Système exécutif
Les fuseaux de sommeil: cette activité électrique prend naissance dans le noyau réticulaire thalamique GABA ergique. Ces neurones entraînent des hyperpolarisations cycliques suivies de bouffées de potentiels à la fréquence des fuseaux (7-14 Hz) dans les neurones thalamocorticaux. Ces hyperpolarisations sont à l'origine du blocage des messages sensoriels au début de l'endormissement (11).
Les ondes lentes de grande amplitude sont le résultat de la sommation des hyperpolarisations des cellules pyra midales de la couche V du néocortex, induites par des interneurones ou des projections GABA venant du noyau basal de Meynert. Ces hyperpolarisations de longue durée sont dues à un courant potassique sortant calcium dépendant (11).
Cette synchronisation de l'activité électrique cérébrale est le résultat de mécanismes de type pacemaker. En effet, le noyau réticulaire thalamique, isolé de toute afférence, continue à osciller rythmiquement (fig. 2a). Son fonctionnement spontané dépend donc de la levée des influences inhibitrices.
Système permissif
L' acétylcholine, I'histamine et la noradrénaline exercent les principales inhibitions (fig. 2b). L'application locale d'atropine (antagoniste cholinergique) ou le blocage de la synthèse de ces amines déclenchent l'apparition des fuseaux et des ondes lentes corticales.
Eveil
Un réseau assez complexe d'une dizaine de structures situées en cascade du tronc cérébral inférieur au télencéphale basal et au cortex prend en charge l'éveil. Ce réseau exécutif est contrôlé par un système activé par un élément de l'éveil.
Réseau exécutif
Très schématiquement, les composantes du réseau peuvent être groupées en deux systèmes, une voie ventrale et une voie dorsale (fig. 3). Au niveau bulbaire, une partie du noyau magnocellulaire est à l'origine des deux voies. En se projetant sur l'hypothalamus postérieur et le noyau de Meynert, il forme la voie réticulo-hypothalamo corticale. Il projette également sur les noyaux mésopontins cholinergiques et la formation réticulée mésencéphalique (asparte/glutamate) qui, à leur tour, stimulent le système diffus thalamique et forment la voie réticulo-thalamo-corticale.
L'hypothalamus postérieur contient le seul groupe de neurones synthétisant I'histamine. Ils sont actifs pendant l'éveil et s'arrêtent pendant le sommeil. La pharmacologie de l'histamine soutient son rôle important dans l'activation cortical (12) et permet d'expliquer la somnolence induite par les antihistaminiques. D'autres neurones non histaminergiques sont actifs pendant l'éveil et le sommeil paradoxal. La lésion électrolytique de l'hypothalamus postérieur entraîne un coma prolongé avec une synchronisation corticale, alors que cet effet n'est que transitoire après une lésion uniquement neuronale par l'acide iboténique (13).
A côté de l'histamine, les autres systèmes aminergiques font partie intégrante de l'éveil.
Le locus coeruleus contient des neurones noradrénergiques, actifs au cours de l'éveil, envoyant des projections directes vers le cortex. L'inhibition de la synthèse de la noradrénaline entraîne une synchronisation corticale transitoire.
Le raphé antérieur contient des neurones à sérotonine, actifs pendant l'éveil, se projetant directement vers l'hypothalamus et le cortex. Contrairement aux autres groupes aminergiques, leur lésion non seulement n'entraîne pas de somnolence même passagère mais provoque une insomnie prolongée de plusieurs jours. Cette contradiction est expliquée plus loin. L'ensemble de ces structures du tronc cérébral reçoit des collatérales des afférences sensorielles et végétatives qui participent au maintien de leur activité.
On peut inclure dans le système de l'éveil le noyau suprachiasmatique (NSC), structure principale de l'horloge biologique. En effet, la répartition des états de vigilance entre le jour et la nuit est influencée principalement par les longues phases d'éveil. La lésion du noyau suprachiasmatique abolit le rythme circadien des états de vigilance par la diminution des longues phases d'éveil et par leur répartition aléatoire dans le nycthémère. Le noyau suprachiasmatique influence cette répartition par un de ses neuropeptides, la vasopressine dont les effets uniquement cérébraux sont à différencier de ceux de la vasopressine hypophysaire, impliquée dans le métabolisme de l'eau.
En résumé, la régulation de l'éveil est un phénomène complexe mettant en jeu des structures multiples et redondantes. Aucune des structures décrites, prise isolément, n'est indispensable à l'activation corticale. De plus, la lésion neuronale combinée des deux structures principales (formation réticulée et hypothalamus postérieur) ne modifie l'éveil que transitoirement. En somme, I'ensemble des conditions suffisantes qui mènent à l'éveil est la condition nécessaire et suffisante de I'inductian et du maintien de l'éveil (13).
Contrôle du système de l'éveil
Le réseau d'éveil, une fois activé, est entretenu par les stimulations internes et externes. Comment l'envie de dormir est-elle à nouveau déclenchée ? Après l'arrêt des stimulations, I'endormissement est la résultante d'un mécanisme généré par l'éveil lui même.
Un système anti-éveil responsable de l'endormissement
La remise en cause de la sérotonine comme l'hormone du sommeil a débouché sur la définition de ce réseau de l'endormissement (encadré 1).
Ainsi, une des composantes de l'éveil, la sérotonine, stimule, par une partie de ses terminaisons, I'aire préoptique qui, en retour, inhibe l'ensemble du réseau de l'éveil. L'éveil provoque sa propre inhibition. C'est donc bien un système anti-éveil qui facilite l'endormissement.
Le rôle de la sérotonine dans l'endormissement résoud la contradiction signalée plus haut. En effet, la lésion du raphé et la parachlorophénylalanine (pCPA) entraînent la diminution de la sérotonine dans toutes les terminaisons corticales et hypothalamiques. L'absence d'ondes lentes est ainsi la conséquence de la non-mise en route du système anti-éveil.
Au niveau bulbaire, le noyau du faisceau solitaire joue également un rôle dans l'endormissement. La stimulation des nerfs vago-aortiques et du sinus carotidien provoque l'endormissement d'un animal insomniaque (14). Les médecins de l'Antiquité avaient déjà fait cette observation. En effet, le mot carotide vient du grec signifiant "qui provoque un sommeil profond". Le système anti-éveil est un processus de régulation prédictif. Il est situé à un carrefour stratégique (aire préoptique) contrôlant des fonctions vitales: thermorégulation, faim, reproduction, etc. Le système anti-éveil intégrerait l'état fonctionnel de l'organisme et déclencherait le sommeil avant son épuisement, à un moment précis du nycthémère indiqué par l'horloge biologique.
Le rebond de sommeil, expression renforcée du système anti-éveil
Après une privation, I'augmentation du sommeil (rebond) est attribuée à l'accumulation de substances hypnogènes produites pendant l'éveil prolongé. Cependant, il est possible de supprimer le rebond sans modifier le sommeil spontané (15). De ce résultat (dissociation rebond-éveil prolongé), découle la notion que le rebond est produit par un mécanisme indépendant de celui du sommeil. Cette boucle de régulation renforce l'effet anti-éveil. Une partie (50 %) de ce rebond est due au stress inhérent aux méthodes de privation (16). C'est ce mécanisme surajouté qui pourrait provoquer l'accumulation de substances hypnogènes. Cette interprétation explique le peu d'effet de leur suppression sur le sommeil. Ces substances ne sont pas hypnogènes au sens strict du terme mais plutôt facilitatrices du sommeil en agissant sur un ou plusieurs systèmes permissifs. Elles pourraient être appelées hypnagogues, c'est-à-dire conduisant au sommeil.
Esquisse d'un modèle de régulation du cycle veille-sommeil
On peut résumer la régulation du cycle veille-sommeil-rêve par un schéma très simplifié. Il comprend cinq éléments, les deux pacemakers du sommeil, le système d'éveil inhibiteur du sommeil avec son frein pour l'endormissement et l'horloge biologique pour le rythme circadien (17) (fig. 4). L'alternance sommeil lent-sommeil paradoxal (rythme ultradien) semble avoir un support métabolique. Au cours du sommeil paradoxal, le cerveau consomme autant de glucose et d'oxygène que pendant l'éveil. La durée du rêve est ainsi dépendante des réserves énergétiques disponibles. On sait que l'hypoxie de haute altitude réduit le temps de sommeil paradoxal. A l'opposé, pendant le sommeil lent, se produit une économie d'énergie (diminution du métabolisme général et de la température corporelle) associée à la reconstitution des réserves énergétiques grâce à la synthèse cérébrale de glycogène et de protéines sous l'influence de l'hormone de croissance. L'éveil est la conséquence de deux mécanismes parallèles, I'inhibition du sommeil et l'activation neuronale généralisée. L'activation du réseau de l'éveil est entretenue par l'éveil lui-même. L'observation empirique montre que, lorsque les motivations positives sont suffisamment fortes, il est possible de rester éveillé plus que d'habitude, sans fatigue excessive. L'inhibition du sommeil semble être exercée par un circuit propre à chaque état de sommeil. L'existence d'un contrôle séparé du sommeil lent et du sommeil paradoxal suggère quelques spéculations en relation avec les fonctions prêtées à chaque état de sommeil. Ainsi, un exercice physique intense et une charge thermique élevée pendant l'éveil sont plutôt suivis par une augmentation du sommeil lent. Pour le sommeil paradoxal, sa durée est augmentée à la suite de situations nouvelles, inhabituelles, mettant en jeu la survie, comme les séances d'apprentissage dans un labyrinthe ou le stress d'immobilisation (18,19). En rejouant son répertoire génétique pendant le sommeil paradoxal (20), I'animal y confronte sa nouvelle expérience et peut l'intégrer dans son répertoire. Lorsque l'apprentissage est maîtrisé ou lorsque l' animal est habitué au stress répété, le sommeil revient aux valeurs de contrôle (19). La privation de sommeil perturbe l'acquisition de la maîtrise de ces situations de survie. Chez l'homme, la suppression prolongée du sommeil paradoxal par les IMAO ne semble pas perturber la mémorisation. Cependant, les batteries de tests ne mettent pas le sujet dans des conditions de survie analogues à celles de l'animal.
Implications cliniques de ce modèle du sommeil
Les troubles du sommeil par atteinte des deux pacemakers semblent assez rares. Pour les insomnies d'endormissement, objectivement constatées et non secondaires à une affection somatique ou psychiatrique, notre modèle confirme ce que la plupart des cliniciens ont observé : I'insomnie n'est pas un trouble du sommeil mais un trouble de l'éveil. Deux mécanismes peuvent être invoqués : la persistance de l'activité du réseau de l'éveil et l'hypoactivité du système anti-éveil.
Stimulation de l'éveil
Le milieu extérieur (lumière, bruit, température...), le milieu intérieur (faim, soif, douleur...) et les stimulations affectives (émotions, anxiété) ou cognitives sont de puissants facteurs éveillants. Pour la sécurité de l'individu, I'éveil est prioritaire.
Hypoactivité du système anti-éveil
Si les facteurs précédents ne sont pas impliqués, une perturbation du réseau anti-éveil est à rechercher, comme une diminution de l'activité (synthèse ou libération) des neurones à sérotonine qui induisent la synthèse des substances hypnagogues. Cela pourrait expliquer l'effet hypnogène de certains antidépresseurs. Ces anomalies pourraient également être la conséquence de la dégénérescence neuronale due au vieillissement ou post-traumatique. L'insomnie par "perception erronée du sommeil" s'observe chez les personnes âgées et dans les suites post opératoires d'interventions ayant nécessité une anesthésie prolongée. Les personnes ont l'impression de ne pas avoir dormi alors que les enregistrements montrent le contraire. Cette plainte de sommeil est attribuable, en fait, à un trouble de la mémoire, c'est l'hypnagnosie de Jouvet.
Le retard de phase de l'horloge biologique est souvent interprété comme une insomnie (voir article d'O. Benoit, page 2443). A partir de ces interprétations, l'approche thérapeutique proposée pourra être de type comportemental, éventuellement associée à la pharmacologie pour stimuler le système anti-éveil. Quant à l'hypnagnosie, la rééducation mnésique peut aider la personne à se souvenir de son sommeil. Les hypersomnies idiopathiques ou post-traumatiques peuvent être rapportées soit à une hypoactivité du réseau de l'éveil, soit à un hyperfonctionnement du système anti-éveil. Pour ces affections, seule une approche pharmacologique est actuellement envisageable. La stimulation des composantes du réseau de l'éveil est possible par de nombreuses molécules. Pour réduire l'activité du système anti-éveil, les molécules sont encore à définir.
Conclusion
L'approche physiologique des mécanismes du sommeil a permis d'identifier la plupart des structures cérébrales impliquées dans chacun des trois états de vigilance. Les connaissances acquises sur l'anatomie, la biochimie et la pharmacologie de ces trois réseaux neuronaux permettent de proposer un schéma général de régulation qui peut être très utile dans la compréhension et l'abord thérapeutique des troubles de l'éveil et du sommeil. Actuellement, I'accent est mis sur l'importance de l'éveil dans la régulation du sommeil. La diffusion la plus large de cette manière d'envisager le sommeil devrait entraîner une réduction significative de la prescription de nombreux psychotropes utilisés comme somnifères.
Mechanisms of the sleep dream waking cycle
For the occurrence of each state of sleep (slow wave sleep, paradoxical sleep) there are two neuronal networks. The first one called executive is responsible for the sleep phenomenology; the second called permissive is for the triggering of sleep. Wakefulness depends on a very complex system (10 structures) including the permissive networks which inhibit sleep. Sleep onset is thought as a blockade of the waking state by an antiwake network synthesizing hypnogenic factors. Such a regulation allows to suggest that insomnia is a wake trouble depending on a revisited therapy.
Sérotonine et sommeil
La sérotonine est synthétisée en deux étapes dans les neurones du raphé à partir du tryptophane circulant:
tryptophane (Tp) -Tp-hydroxylase-> 5-hydroxytryptophane (5-HTP) -5-HTP-décarboxylase-> sérotonine (5-HT) -mono-amine-oxydase (MAO)-> Ac.5-hydroxy-indol-acétique (5-HIAA)
La lésion de ces neurones entraîne une insomnie prolongée et une baisse de la sérotonine cérébrale. De plus, le blocage de la tryptophane hydroxylase par la parachlorophénylalanine (pCPA) provoque également une insomnie qui est renversée par l'administration du précurseur immédiat (S-HTP) de la sérotonine. A partir de ces observations, la sérotonine a été considérée comme l'hormone du sommeil.
Cependant, plusieurs arguments sont venus s'opposer à cette théorie. L'activité unitaire des neurones du raphé est maximale pendant l'éveil, diminue au début du sommeil et s'arrête pendant le sommeil paradoxal. Ce silence électrique est associé à l'arrêt de la libération synaptique de la sérotonine. Ces résultats suggèrent que le rôle de la sérotonine est indirect. Au cours de l'éveil, la sérotonine agirait sur une structure relais qui synthétiserait, avec un certain délai, une ou des substance(s) induisant le sommeil. Cette structure a été mise en évidence par le modèle pCPA-5-HTP. L'insomnie induite par la pCPA est renversée par le 5-HTP uniquement si l'injection est effectuée au niveau de l'hypothalamus antérieur. La lésion de cette région provoque une insomnie de très longue durée (3 semaines) qui est, à son tour, renversée par l'injection de muscimol dans l'hypothalamus postérieur, lieu de convergence de plusieurs éléments du système d'éveil . Ce résultat suggère que l'hypothalamus antérieur n'est pas un centre du sommeil, mais plutôt une région exerçant une inhibition de l'éveil.
L'introduction de la mesure in vivo de la libération de la 5-HT par la voltamétrie a relancé l'intérêt pour l'action hypnogène immédiate de la sérotonine. Si la libération synaptique de 5-HT diminue pendant le sommeil, par contre, au niveau des corps cellulaires du raphé, la 5-HT, minimale au cours de l'éveil, augmente au début du sommeil et atteint son maximum pendant le sommeil paradoxal. Cette sérotonine, libérée par les dendrites, agirait sur des autorécepteurs qui provoqueraient l'inhibition des neurones du raphé. Ainsi, s'expliquerait l'endormissement (18).
Le rêve des chats
Au cours du sommeil paradoxal, I'activité électrique transitant dans le faisceau pyramidal est aussi intense que pendant l'éveil actif. L'inhibition active des motoneurones spinaux empêche l'expression de cette commande motrice. Que se passe-t-il si les neurones responsables de l'atonie musculaire sont lésés ? L'éveil et le sommeil lent ne sont pas modifiés. Le sommeil paradoxal survient avec toutes ses caractéristiques, excepté I'atonie musculaire. L'animal, n'étant plus paralysé, redresse la tête, se lève et accomplit un certain nombre de comportements caractéristiques de I'espèce. Le chat se met à l'affût devant une proie imaginaire, fait le gros dos, le poil hérissé, souffle comme s'il était devant un ennemi effrayant, fait sa toilette, joue avec une balle ou une souris invisibles. La durée (5 à 6 min) des périodes oniriques (par analogie au rêve humain) est identique à celles des phases de sommeil paradoxal observées avant la lésion (21).
L'expression de ces comportements résulte de l'activation de circuits neuronaux bien identifiés du système limbique. Leur stimulation pendant I'éveil déclenche à volonté leur manifestation. Basée sur ces observations, la fonction du sommeil paradoxal, au cours de l'ontogenèse, serait de mettre en place ces circuits. Chez I'adulte, elle servirait à les maintenir afin de préserver la personnalité ou de les modifier en fonction de l'expérience vécue, en vue d'une meilleure adaptation à l'environnement (22).
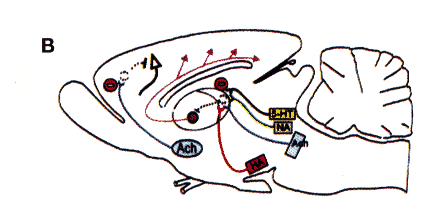
Figure 1 : Réseau exécutif du sommeil paradoxal
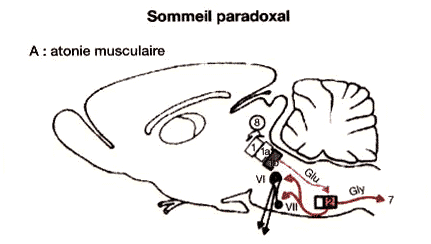
Atonie musculaire: des neurones du complexe de locus coeruleus (1b) se projettent sur les motoneurones spinaux (7) et les noyaux des nerfs crâniens (Vl, Vll) par l'intermédiaire du noyau magnocellulaire bulbaire (2). Un des contrôles permissifs est représenté par des neurones de la substance grise périaqueducale (8).
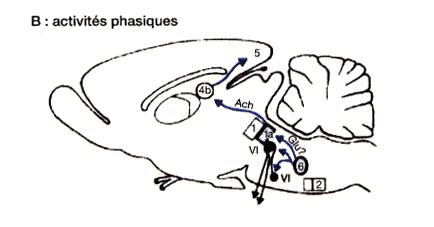
Activités phasiques. Le générateur des activités phasiques est figuré en (6). Il est connecté avec les noyaux oculomoteurs et les neurones "PGO-on" (1a) se projetant sur le corps genouillé latéral (4b) et le cortex (5).
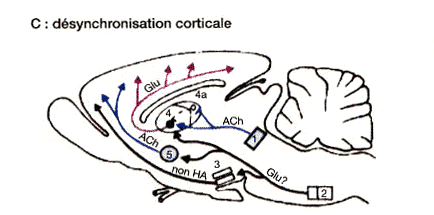
Désynchronisation corticale. Les neurones cholinergiques (Ach) mésopontins (1) agissent sur des récepteurs muscariniques inhibiteurs du noyau réticulaire du thalamus (4a) et sur des récepteurs nicotiniques excitateurs des noyaux intralaminaires du thalamus. Des neurones du noyau magnocellulaire bulbaire (2) se projettent sur l'hypothalamus postérieur non histaminergique (3), le thalamus et le noyau de Meynert (5).
Les neurotransmetteurs sont indiqués par leur abréviation courante:
- Ach = acétylcholine;
- GABA = Ac. gamma-amino-butyrique;
- Glu =glutamate;
- Gly =glycine;
- HA = histamine.
- GABA = Ac. gamma-amino-butyrique;
Figure 2 : Réseaux exécutif (A) et permissif (B) du sommeil lent
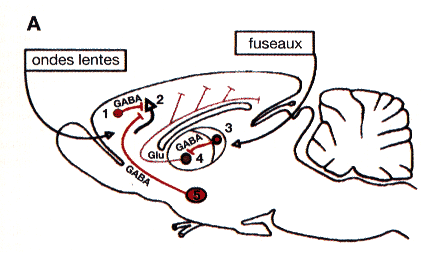
Les ondes lentes sont la résultante d'une inhibition GABAergique venant des interneurones corticaux (1) ou du noyau de Meynert (5) et s'exercant sur les cellules pyramidales (2).
Les fuseaux prennent leur origine dans le thalamus, noyau réticulaire (3) et neurones thalamo-corticaux (4). Le controle du pacemaker s'effectue par les afférences inhibitrices principalement cholinergiques (Ach), histaminergiques (HA), noradrénergiques (NA) et sérotoninergiques (5-HT).
Figure 3 : Réseau de l'éveil et de l'endormissement
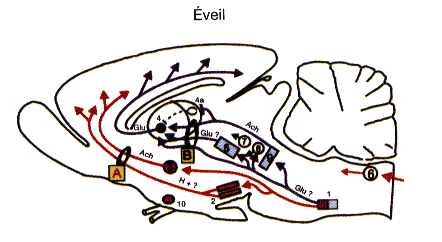
Pour l'éveil, une dizaine de structures sont regroupées en deux voies (A, B).
A: voie réticulo-hypothalamo-corticale (bleue).
B: voie réticulo-thalamo-corticale (rouge).
- 1 = noyau réticulé bulbaire magnocellulaire;
- 2 = hypothalamus postérieur (histamine);
- 3 = noyau basal de Meynert (Ach);
- 4 = noyaux intralaminaires (Glu) et 4a = noyau réticulaire du thalamus (GABA);
- 5 =formation réticulée mésencéphalique (Glu ?);
- 6 = complexe du faisceau solitaire recevant les afférences végétatives;
- 7 = raphé dorsal (5-HT);
- 8 = locus coeruleus (NA);
- 9 = neurones mésopontins (Ach);
- 10 = noyau suprachiasmatique.
- 2 = hypothalamus postérieur (histamine);
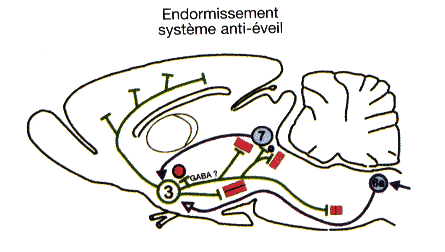
Pour l'endormissement, un système inhibiteur de l'éveil (3) situé dans l'hypothalamus antérieur est mis en route par des afférences sérotoninergiques (5-HT) du raphé (7) et des afférences venant du bulbe rachidien (6a) recevant les stimulations vago-aortiques.
Figure 4 : Schéma de la régulation du cycle veille-sommeil-rêve
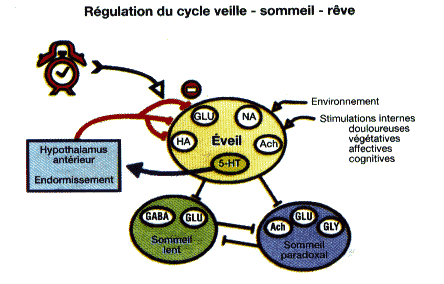
Les pacemakers du sommeil lent et du sommeil paradoxal sont sous le contrôle inhibiteur de l'éveil. L'éveil, réseau complexe de structures multiples et redondantes, est entretenu par les stimulations de l'environnement et du milieu interne. L'endormissement est le résultat du blocage de l 'éveil à un moment donné du nycthémère (horloge biologique) par un système anti-éveil situé dans l 'hypothalamus et mis en route par une des composantes de l'éveil, la sérotonine (5-HT). Ce schéma permet de comprendre que les insomnies sont un trouble de l'éveil consécutif soit à une persistance des stimulations éveillantes soit à un hypofonctionnement de l'anti-éveil, soit encore à un retard de phase de l'horloge.