| Sur l'existence d'un système hypnique ponto-limbique ses rapports avec l'activité onirique |
| Michel Jouvet Colloques Internationaux du CNRS, Montpellier (1961) |
Résumé
Des données expérimentales établies sur des chats chroniques, intacts, décortiqués et porteurs de section ou de coagulation du tronc cérébral, permettent de préciser les structures responsables de la phase de sommeil avec activité rapide corticale (Phase Rhombencéphalique du Sommeil - P.R.S.). La P.R.S. dépend de la mise en jeu périodique d'un groupe cellulaire situé au niveau du noyau R.P.C., au niveau de la F.R. pontique. Les voies nerveuses corticipètes responsables de l'activité rapide corticale sont différentes du système activateur ascendant. Elles sont en relation étroite avec le système limbique. Il existe en outre au cours de la P.R.S., qui constitue le stade le plus profond du sommeil, un ensemble caractéristique de manifestations somato-végétatives (mouvements rapides des yeux, disparition du tonus musculaire) dont certaines semblent être sous la dépendance de la Formation Reticulée inhibitrice. Des investigations effectuées chez l'homme normal, ou atteint de syndrome de décortication ou de décérébration, permettent d'assimiler la phase de sommeil onirique avec mouvements rapides des yeux à la P.R.S. L'activité onirique apparaît ainsi sous la dépendance d'un système Ponto-Iimbique périodiquement mis en jeu au cours du sommeil.
Summary
Recollection of dreams occurs when a sleeping subject is aroused during the stage of sleep with low voltage E.E.G. activity associated with rapid eyes movements. This fact has led to the hypothesis that such a stage of sleep is associated with dreaming.
A similar stage of sleep with fast cortical activity and rapid eyes movements has been described in the cat. The neurophysiological mechanisms underlying this stage have been studied in chronic intact, decorticate, mesencephalic and pontile cats. Results show that the periodical cortical activity during sleep (Rhombencephalic Phase of Sleep: R.P.S.) is dependent upon the triggering of a system situated at the level of the nucleus reticularis pontis caudalis, in the pontine reticular formation. This system controls the somato vegetative phenomena which are highly characteristics of the R.P.S. (Disapperance of all muscular tonic activity even in the cases of decerebration and decerebellation hypertony, variation in respiratory and cardiac rhythms). The fast cortical and the slow 5/sec rhythmic hippocampal activities occuring during the R.P.S. are not suppressed by t he interupti on of the mesencephalic reticular formation, but are suppressed by lesion of the ventral mesencephalon, the hypothalamus and the septum. It is suggested that connections between the pontine reticular formation and the limbic system may take the "limbic midbrain circuit" described by Nauta.
The R.P.S. is more profound than the phase of sleep with slow cortical activitv as the threshold of awakening is increased in comparison with the slow phase of sleep. The R.P.S. can be triggered of in animals by stimulating the brain stem and some results suggest that a neuro humoral mechanism may be responsible for the periodical appearance of the R.P.S. Investigations on normal human subjects confirm that dreaming is associated with the stage of sleep with rapid eyes movements. A specific E.E.G. rhythm is described during this stage. Results obtained on chronic decorticate and decerebrate human subjects have confirmed the main results obtained in the cat, and lead to the conclusion that the stage of sleep with rapid eyes movements in human is similar to the R.P.S.
Such results suggest that dreaming occurs periodically during sleep when a ponto-limbic system is brought into play probably by a neuro humoral mechanism.
L'activité onirique ne peut être décelée que par son équivalent subjectif, le souvenir souvent fugitif d'un rêve. Aussi toute tentative de délimitation des structures nerveuses responsables d'un phénomène aussi mystérieux que le rêve peut sembler hasardeuse. Des données récentes, établies sur l'homme et l'animal, rendent cependant moins téméraire un tel essai. Les travaux de KLEITMAN et de ses collaborateurs [1, 12, 13] ont en effet démontré chez l'homme l'apparition périodique d'un stade particulier du sommeil de nuit, caractérisé par une activité E.E.G. de bas voltage et des mouvements des yeux. Les réveils provoqués au cours de ce stade s'accompagnent dans un grand nombre de cas de souvenir de rêve [12]. Chez le chat, d'autre part, à côté de l'activité électrique corticale lente caractéristique du sommeil physiologique [36], l'existence de phases d'activité rapide néocorticale [13], associée à une activité rythmique lente hippocampique [37], avait été remarquée. DEMENT [9] signalait en outre la récurrence périodique d'une telle activité, son association avec des mouvements des yeux et l'assimilait à un "sommeil activé" (activated sleep) intermédiaire entre l'éveil et la phase E.E.G. lente du sommeil. Les caractéristiques électriques cortico-sous-corticales du sommeil avec activité corticale rapide et les manifestations somato-végétatives qui l'accompagnent [9, 26] se prêtent particulièrement bien à l'analyse des structures nerveuses qui en sont responsables. Enfin, les analogies surprenantes de ce phénomène chez l'homme et l'animal rendent possible la confrontation entre son analyse structurelle expérimentale chez le chat et les données subjectives humaines.
Nous commencerons ainsi par exposer les faits expérimentaux établis sur le chat, qui permettent de délimiter un système pontolimbique, responsable de la phase d'activité rapide corticale au cours du sommeil (phase rhombencéphalique du sommeil) (P.R.S.) [20] [21].
Nous montrerons ensuite la similitude de tette phase de sommei] avec celle qui est observée chez des sujets humains normaux ou porteurs de diverses atteintes pathologiques, réalisant de façon approchée les lésions de l'expérimentation animale. Enfin, nous discuterons les rapports de cette phase de sommeil avec l'activité onirique.
Données expérimentales établies sur le chat : la phase rhombencéphalique du sommeil
Des électrodes corticales et sous-corticales Ont été chroniquement implantées sur 68 chats chroniques intacts, décortiqués, décérébellés ou porteurs de section totale ou de coagulation limitée du tronc cérébral. L'activité E.M.G. des muscles de la nuque, les mouvements des yeux, l'électrocardiogramme et la respiration étaient enregistrés en même temps que l'activité électrique cérébrale. Les animaux étaient enregistrés sur un appareil E.E.G. au cours des différentes phases du sommeil physiologique pendant au moins une semaine. La position des électrodes et la topographie des lésions ont été vérifiées dans tous les cas par des coupes sériées colorées par les méthodes de NISSL, de LOYEZ et de LUXOL FAST BLUE.
Données expérimentales établies sur le chat : la phase rhombencéphalique du sommeil
Résultats
l. - Les deux aspects E.E.G. du sommeil physiologique chez le chat intact
A - "Le sommeil lent" (70 à 80% de la durée du sommeil comportemental) se traduit par l'apparition d'une activité de fuseaux de 19 à 18 c/s au niveau du cortex du thalamus, de la formation réticulée (F.R.) mésencéphalique et pontique. Des ondes lentes de 2 à 4 c/s apparaissent ensuite au niveau de ces mêmes structures. Pendant ce temps, l'activité de l'hippocampe est caractérisée par des pointes de haut voltage (500 à 800 microvolts) [24]. Au cours de ce stade, il persiste toujours une activité E.M.G. au niveau de la nuque et le seuil d'éveil par stimulation réticulaire s'élève de 30 à 50 % par rapport au stade d'endormissement. L'origine télencéphalique de la phase de "sommeil lent" est probable: il n'est plus possible en effet d'enregistrer des fuseaux ou des ondes lentes au niveau des différentes formations souscorticales chez des animaux totalement décortiqués ou en arrière d'une section totale du tronc cérébral à la limite mésodiencéphalique. Cette phase de sommeil semble donc traduire l'expression d une activité corticifuge dont les mécanismes de mise en jeu ont été discutés ailleurs [21, 23].
B - "Phase de sommeil rapide" ou Phase Rhombencéphalique du Sommeil (P.R.S.) (fig. 1C).
Elle fait toujours suite à une phase de sommeil lent et n'apparaît jamais d'emblée après l'éveil. Son allure comportementale est caractéristique:
Il existe une totale atonie de l'animal caractérisce par une chute brusque de la tête. Parallèlement l'actilité E..M.G. des muscles de la nuque disparaît toujours totalement, tandis que surviennent des mouvements rapides des yeux, des vibrisses, plus rarement de brèves secousses des oreilles, des machoires, de la queue ou des extrémités. Il apparaît enfin des variations végétatives de facon constante: le rythme respiratoire devient irrégulier, plus superficiel et surtout plus rapide qu'au cours de la phase d'ondes lentes du sommeil, tandis que le rythme cardiaque se ralentit.
Au point de vue E.E.G., la P.R.S. se caractérise par une activité corticale, diencéphalique et mésencéphalique, rapide et de bas voltage, similaire à celle de l'éveil. Cette activité coïncide avec la disparition de l'E.M.G. de la nuque ou parfois peut la précéder ou la suivre de quelques secondes. L'hippocampe ventral et dorsal présente alors de façon presque continue un rythme théta à 5/s, très régulier, qui ressemble à celui décrit par GREEN et ARDUINI [16] au cours de l'éveil. Dans nos expériences cependant, nous n'avons noté qu'exceptionnellement un tel rythme au cours de l'état de veille. Au niveau du noyau Reticularis Pontis Caudalis (R.P.C.) des ondes à 8 c/s de haut voltage, ayant une allure de fuseaux apparaissent. Elles sont parfois associées à un rythme à 5 c/s, similaire à celui de l'hippocampe. Une activité rythmique identique a été également enregistrée au niveau de la substance grise péri-aqueducale, du noyau inter-pédonculaire et de l'hypothalamus postérieur. Au cours de cette phase enfin, les réponses évoquées auditives, corticales ou réticulaires, ont une amplitude moindre qu'au cours de l'éveil ou de la phase de sommeil lent. Une telle phase de sommeil, dont la durée moyenne est de 10 à 15 minutes, se répète périodiquement au cours du sommeil comportemental, séparée par des intervalles de 10 à 30 minutes. Elle correspond ainsi à 20 ou 30 % de la durée du sommeil.
Au cours de cette phase le seuil d'éveil par stimulation réticulaire ou sensorielle s'élève de façon notable par rapport à la phase de sommeil lent [17, 18 , 25, 38]. Cette caractéristique, associée aux signes E.E.G. sous-corticaux, à la disparition totale du tonus musculaire et aux phénomènes somato-végétatifs, permet ainsi de déceler l'apparition périodique des P.R.S. chez des animaux ayant subis des mutilations du névraxe à des niveaux divers.
Données expérimentales établies sur le chat : la phase rhombencéphalique du sommeil
Résultats
II. - Structures responsables de la P.R.S.
A) Les structures nerveuses nécessaires et suffisantes au déclenchement périodique de la P.R.S.:
Le cervelet, dont on pourrait légitimement invoquer la mise en jeu devant l'atonie si caractéristique de la P.R.S. n'est pas en cause, puisque des P.R.S. tvpiques au point de vue E.E.G. et comportemental continuent à apparaître chez des animaux totalement cérébellectomisés.
Chez l'animal totalement néodécortiqué, les P.R.S. s'individualisent très nettement (fig. 2).
Au point de vue E.E.G. apparaissent des fuseaux de haut voltage au niveau du noyau R.P.C., tandis que l'hippocampe présente un rythme régulier à 5 c/s. Au niveau du thalamus, il persiste la même activité rapide et de très bas voltage qu'au cours de l'éveil.
Au point de vue comportemental, la diminution du tonus musculaire est totale et l'activité E.M.G. disparaît. Des mouvements des yeux apparaissent. Ils sont similaires à ceux de l'animal normal, mais moins fréquents. La durée des P.R.S. est de 10 à 15 minutes.
Section du tronc cérébral (fig. 3. 4)
Des sections totales du tronc cérébral en avant du pont n'empêchent pas l'apparition périodique des P.R.S. Dans le cas d'animaux pontiques chez qui la partie de l'encéphale située en avant du l'ont fut enlevée deux états comportementaux pouvaient être remarqués.
L'état de veille était caractérisé par une rigidité très importante avec hyperextension des membres antérieurs. A ce stade l'activité souscorticale enregistrée au niveau des noyaux Reticularix Pontis Oralis et R.P.C. était rapide et de bas voltage, tandis que l'activité musculaire au niveau des muscles de la nuque était très importante (fig. 4)
Le deuxième état était représenté par les P.R.S., leur périodicité et leur durée étaient semblables à celles des animaux intacts et leurs aspects étaient identiques au tableau de "cataplexie" décrit par BARD et MACHT [2] chez des préparations mésencéphaliques et pontiques chroniques. Elles étaient caractérisées pal une flaccidité totale de l'animal avec disparition de la nuque. Il n'y avait pas de mouvements des yeux, mais seulement quelques clignements des paupières, un ralentissement du rythme cardiaque et une accélération respiratoire. Au point de vue électrique apparut une activité rythmique lente et régulière à 3 c/s au niveau de la formation réticulée pontique.
Une telle constatation démontre que les structures nerveuses responsables du déclenchement de la P.R.S.S. sont situées en arrière du mésencéphale. La délimitation des limites postérieures de ces structures a été plus délicate, acr il s'est avéré extremement difficile de conserver plusieurs jours des animaux sectionnés en arrière du Pont. Deux préparations cependant ont survecu une semaine après ablation totale du cervelet et une section totale du tronc passant dorsalement au niveau des deux tiers postérieurs dn R.P.S. et se terminant ventralement à la jonction du Pont et des corps trapézoïdes.
Les phénomènes dépendant des structures situées en avant de la section peuvent se classer en trois stades E.E.G. et comportementaux:
1) Un stade d'éveil cérébral: les pupilles sont dilatées de 2 à 3 mm. Les yeux peuvent alors suivre un objet mouvant verticalement dans leur champ visuel. Au cours de ce stade, le corticogramme est rapide et de bas voltage. Un tel aspect correspond exactement à celui qui a été décrit chez la préparation médiopontine par BATINI et COLL [3, 4, 5].
2) Un stade de sommeil cérébral: les pupilles sont en myosis, il n'y a aucun mouvement de fixation lorsqu'un objet mouvant se déplace dans le champ visuel. I1 existe alors des fuseaux au niveau du cortex. Les périodes de fuseaux très courtes les premiers jours (15 à 20 % de la durée de l'enregistrement) deviennent ensuite plus longues et finissent par occuper vers le septième jour 50 % du temps total d'enregistrement.
A côté de ces deux stades dont l'interprétation en terme de comportement est relativement facile, il existe un "stade d'interprétation difficile" : le myosis est en effet très serré, il peut exister quelques mouvements oculaires spontanés, mais l'animal ne peut plus suivre aucun objet mouvant. Cependant l'activité cérébrale est rapide. Si une stimulation olfactive est appliquée à ce stade, elle entraîne alors une légère mydriase et l'animal peut alors suivre un objet sans que son activité cerébrale ne change. D'autre part des stimulations de l'hippocampe au cours de cette période peuvent entraîner l'apparition de fuseaux corticaux.
Les structures cérébrales situées en arrière de la section du tronc sont responsables par contre d'un "état de vigilance somatique" permanent caractérisé par une activité E.M.G. importante de la nuque et il n est jamais apparu de période d'atonie accompagnée de disparition de l'activité E.M.G. L'analyse des rythmes cardiaque et espiratoires n'a pas permis non plus de mettre en évidence de variation périodique analogue à une P.R.S.. Il semble ainsi que les structures bulbaires et médullaires soient incapab]es de déclencher l'apparition périodique de P.R.S. comportementales lorsqu'elles sont déconnectées du Pont.
Les structures nerveuses responsables de la P.R.S. sont donc situées en avant d'une section rétro-pontique et en arrière d'une section pré-pontique. C'est pourquoi des lésions limitées ont été placées au niveau de la F.R. pontique dans le but de supprimer électivement les aspects E.E.G. et comportementaux de la P.R.S.:
Lésions de la Formation Réticulée Pontique (fig. 5).
La destruction du noyau R.P.C. entraîne une disparition totale des phénomènes corticaux et périphériques de la P.R.S. Chez 4 animaux, la lésion intéressait en effet exclusivement les 4/5 ou la totalité du noyau R.P.C. et épargnait totalement le noyau giganto-cellulaire. Elle intéressait en outre le quart postérieur et inférieur du noyau Reticularis Pontis Oralis R.P.O.. Chez un cinquième animal, la lésion intéressait le R.P.C. de façon totale et les 3/4 médians et antérieurs du noyau giganto-cellulaire. Les lésions épargnaient totalement le R.P.O. La lésion commune aux animaux intéresse donc le R.P.C..
Ces chats étaient capables de se tenir debout et de marcher en titubant. Ils pouvaient se nourrir seuls. Chez tous apparurent des modifications périodiques et paroxystiques du comportement à partir du troisième et quatrième jour. De façon périotlique, deux à trois fois par heure, ils regardaient fixement devant eux, la tête levée, les pupilles dilatées et ils essayaient d'atteindre sans cesse avec leur patte antérieure un objet imaginaire. Ces réactions de type hallucinatoires s'accompagnaient d une activité rapide corticale et rythmique hippocampique.
Au point de vue E.E.G. les enregistrements des deux premiers jours étaient presque entièrement constitués par un corticogramme rapide et de bas voltage et une activité théta hippocampique associée à un comportement de veille. Les jours suivants cependant des phases de sommeil lent avec fuseaux corticaux et ondes lentes corticales et sous-corticales réapparurent pendant 50 à 60 % du temps d'enregistrement. La réaction d'éveil E.E.G. et comportementale était normale. A aucun moment, malgré des observations continues de jour et de nuit, n'apparurent de P R S. Car aucune activité rapide au cours du sommeil comportemental, aucun relâchement du tonus musculaire avec disparition de l'E.M.G. des muscles de la nuque ne purent être observés. Cependant respectivement vers le quinzième jour des P.R.S. réapparurent chez 4 animaux. Elles étaient très courtes et ne dépassaient pas 2 à 3 minutes. Elles survenaient avec une périodicité identique à celle des contrôles pré-operatoires, mais leur durée n'atteignait pas alors 1% du temps d'enregistrement. Ainsi, la destruction du noyau R.P.C. entraîne la disparition totale des phénomènes E.E.G. et périphériques caractéristiques de la P.R.S. Pour cette raison, noux avons proposé de donner à la phase d'activité rapide corticale au cours du sommeil, le nom de P.R.S. qui semble plus explicite que celui de "phase paradoxale" que nous avions proposé précédemment [25] .
B) Les voies nerveuses responsables des phénomènes E.E.G. au cours de la P.R.S.:
La situation des structures déclenchantes de la P.R.S. avant été délimitée au niveau du noyau R.P.C., des lésions limitées du tronc cérébral, en avant de ce noyau, ont été réalisées afin d'essaver de supprimer électivement l'activité rapide néocorticale et l'activité rythmique hippocampique caractéristique de cette phase de sommeil.
1) Des lésions des parties latérales du tronc cérébral intéressant les voies specifiques ascendantes et laissant intactes la F.R. mésencéphalique et la partie verticale du tronc, laissent persister les signes E.E.G. néo- et paléo-corticaux de la P.R.S., du sommeil lent et de l'éveil ainsi que leurs corrélations somato-végétatives. Elles n'intéressent donc pas les voies de projection ascendante du système responsable de l' "activation corticale" au cours du sommeil.
2) Des lésions intéressant la partie antérieure du tegmentum mésencéphalique et respectant le tiers ventral du mésencéphale, suppriment l'activation corticale au cours de l'éveil déclenché par une stimulation de la formation réticulaire [32] en arrière de la lésion. Cependant une telle destruction ne supprime pas la possibilité d'une activité rapide corticale au cours de la P.R.S. De tels animaux ne présentent ainsi une activité rapide corticale qu'au cours de la phase la plus profonde du sommeil. Ce fait laisse supposer que les voies responsables de l'activité rapide corticale au cours de la P.R.S. n'empruntent pas, tout au moins en totalité, le tegmentum mésencéphalique.
3) Des lésions placées aux niveaux suivants: partie médiane du noyau R.P.O., Noyau Centralis Superior de BECHTEREW (fig. 6), région du noyau inter-pédonculaire et de la substance grise péri-épendymaire, région sous-thalamique (hypothalamus médian, hypothalamus latéral, faisceau médian du télencéphale) et enfin septum (fig. 7), suppriment en tout ou en partie, l'activité rapide corticale et l'activité rythmique hippocampique au cours de la P.R.S. De telles lésions laissent cependant persister l'activation corticale au cours de l'éveil. Au cours de la P.R.S le tracé peut parfois s'activer légèrement par rapport à la phase de sommeil lent mais il persiste cependant des fuseaux et l'activité rythmique hippocampique est absente (fig. 8). Les autres symptômes de la P.R.S. par contre sont au complet. Ainsi des lésions placées au niveau de la partie ascendante du "Limbic Midbrain Circuit" [33,34] empêchent l'apparition des signes E.E.G. néo- et paléo-corticaux de la P.R.S. Il est ainsi probable que les voies ascendantes issues du noyau R.P.C. empruntent, tout au moins en partie, un tel système.
Mécanismes de la P.R.S.
L'apparition périodique de la P.R.S. dépend de la mise en jeu d'un mécanisme actif situé au sein de la partie caudale du tronc cérébral. Il est en effet possible de déclencher des P.R.S. typiques au point de vue E.E.G. et comportemental, d'une durée de 10 à 15 minutes, en stimulant la F.R. pontique ou mésencéphalique pendant quelques secondes au cours de la phase de sommeil lent. Ce phénomène a pu être obtenu également chez des animaux décortiqués et mésencéphaliques chroniques. Le déclenchement des P.R.S. par stimulation du tronc cérébral obéit à des conditions temporelles bien définies car les P.R.S. spontanées ou provoquées sont presque constamment suivies d'une phase réfractaire de 10 à 15 minutes pendant laquelle les stimulations sont inefficaces ou provoquent au contraire un éveil. La durée de telles périodes réfractaires et le mécanisme d'enclenchement de P.R.S. de plusieurs minutes après de brèves stimulations, suggèrent qu'un agent neuro-humoral, libéré au niveau du noyau R.P.C. pourrait être responsable de cette phase de sommeil.
L'atropine, aux doses de 0,2 mg/kg supprime l'apparition des P.R.S. E.E.G. et comportementales chez les animaux normaux ou mésencéphaliques. Une telle action est en faveur de l'existence d'un mécanisme neuro-humoral de type cholinergique.
L'ensemble de ces résultats permet ainsi de conclure que la P.R.S. traduit la mise en jeu périodique d'un système dont l'organisation structurale peut être schématisée de la façon suivante (Fig. 9): l'intégrité d'un ensemble neuronique situé au niveau du noyau R.P.C. est nécessaire et suffisante au déclenchement périodique de la P.R.S. Ce "centre" est en relation avec l'écorce par l'intermédiaire de voies ascendantes distinctes du S.R.A.A. Ces voies, empruntant la partie ventrale du mésencéphale, la région sous-thalamique, probablement au niveau du Limbic Mid Brain Circuit, sont en relation étroite avec le système limbique. Les voies descendantes, issues du noyau R.P.C. et responsables des phénomènes somato-végétatifs, sont en relation étroite avec la F.R. inhibitrice ponto-bulbaire [29, 30]. Les mécanismes de la mise en jeu physiologique de ce système sont encore inconnus mais certains résultats suggèrent l'intervention d'un mécanisme neuro-humoral.
Investigations cliniques chez l'homme
Sujets normaux
Méthode : 20 tracés de sommeil de nuit (de 22 heures à 6 heures) ont été effectués sur 6 sujets adultes (deux hommes et quatre femmes de 20 à 35 ans) et trois enfants (16 mois, 22 mois, 3 ans). L'E.E.G. était enregistré en bipolaire au niveau du scalp ainsi que les mouvements des yeux grâce à des électrodes placées de part et d'autre des globes oculaires.
L'activité musculaire au niveau de la nuque ou des sternocleïdo-mastoïdiens, l'électrocardiogramme et enfin la respiration étaient également recueillis sur l'appareil E.E.G. Le seuil d'éveil était testé au moven de stimulations auditives pratiquées par l'intermédiaire d'un haut parleur déclenché par un stimulateur. Lors des éveils provoqués au cours des différents stades de sommeil, il était demandé aux sujets adultes s'ils se souvenaient d'un rêve.
Il est vite apparu au cours de ces enregistrements que l'index électromyographique était infidèle chez l'homme normal, car aussi bien l'E.M.G. des muscles de la nuque que celui des sterno-cleïdo-mastoïdiens disparaît au repos ou dès l'endormissement.
Résultats : nous n'insisterons pas sur les stades de sommeil classiques pour lesquels nous avons adopté la terminologie de DEMENT et KLEITMAN (1957) (fig. 10) et nous ne décrirons seulement avec détail que le stade de sommeil avec mouvements rapides des yeux (M.R.Y.).
Le stade I fait suite à la disparition de l'alpha et s'observe immédiatement après l'endormissement. Il est caractérisé pal une activité de bas voltage relativement rapide et un manque absolu de fuseaux et de K complexes. Il peut être extrêmement court chez certains sujets. Il existe alors des mouvements lents des globes oculaires, svnchrones dans le sens horizontal, d'une fréquence de 10 à 20 par minute. Leur aspect régulier et lent permet de les distinguer facilement des M.R.Y.
Le stade II est caractérisé par la présence d'une activité de fuseaux apparaissant sur un arrière fond d'activité rapide et de bas voltage. Parfois il peut déjà exister une activité théta. C'est à ce stade que sont recueillis les K complexes spontanés ou provoqués au niveau des régions antérieures. Il y a encore des mouvements lents des yeux.
Le stade III est caractérisé par des ondes delta de haut voltage diffuses, auxquelles sont encore associés quelques fuseaux. Les mouvements lents des yeux ont presque disparu.
Enfin, le stade IV est caractérisé par la présence d'ondes lentes delta diffuses, de grande amplitude, sans fuseaux. Les mouvements lents des yeux ont alors disparu. Au cours de ces derniers stades la respiration est régulière, lente, ample et profonde. Le rythme cardiaque se ralentit progressivement, il est très régulier.
La phase de sommeil avec M.R.Y. (fig. 11).
Cette phase possède des signes E.E.G. et comportementaux spécifiques qui permettent de la distinguer très nettement des autres stades de sommeil.
Au point de vue E.E.G. au niveau des régions occipItal.es il existe des bouftfées de rythme alpha très régulier, d'amplitude légèrement réduite et dont la fréquence est souvent de 1 à 2 c/s plus lente que l'alpha de veille. Ces bouffées sont souvent, mais non constamment bloquées au cours des mouvements rapides des yeux. Le reste du tracé est de bas voltage sans rythme décelable. Parfois des bouffées rapides à 20-25 c/s surviennent au niveau des régions frontales. Il n'y a aucun fuseau ni K complexe spontané ou provoqué par les stimulations sensorielles. Toutes ces caractéristiques peuvent cependant s'observer au cours du stade I du sommeil.
Par contre, un type d'activité constant et caractéristique permet de distinguer formellement cette phase du stade I [22]: c'est la présence d ondes lentes encochées, en "dents de scie", de 2 à 3,5 c/s dont l'allure est diphasique dans les enregistrements monopolaires. Leur amplitude est maximum dans les dérivations vertex-pariétales antérieures ou vertex-temporales antérieures. Elles ne s'observent pas sur les régions frontales ou occipItal.es. Elles surviennent par bouffées de quelques secondes. Souvent, mais non constamment, elles précèdent les mouvements des yeux. Elles cessent le plus souvent lorsque ceux-ci apparaissent. Rarement elles prennent l'apparence de bouffées pseudo-rythmiques qui peuvent persister pendant plusieurs minutes. Nous n'avons jamais observé de telles ondes en dehors de cette période de sommeil.
Au point de vue comporternental: des mouvements rapides des yeux ont été décrits par ASERINSKI et KLEITMANN [1], DEMENT et KLEITMANN [12]. Ils apparaissent constamment au cours de cette période et nous n'avons pas encore observé de sujets normaux qui n'en présentent pas. Nous en avons observés chez des enfants de 16 mois, et sur un sujet aveugle de 3 ans. Ce sont des mouvements des yeux synchrones, bilatéraux, horizontaux ou verticaux, qui ressemblent aux mouvements de fixation qu'un sujet peut effectuer en suivant une figure complexe à l'état de veille. Survenant par bouffées de quelques secondes, ils sont séparés par des périodes de repos total au cours desquelles les yeux sont immobiles. Les paupières sont en général relâchées et permettent d'apercevoir la sclérotique. Il existe en outre des mouvements discrets et rapides des commissures labiales et des doigts. Il est exceptionnel qu'il y ait alors des mouvements globaux des membres et du corps. Au cours de ce stade apparaissent en outre des variations végétatives constantes: le rythme respiratoire devient plus irrégulier, plus superficiel et plus rapide, parfois il est entrecoupé de courtes poses lors des mouvements des yeux. L'irrégularité du rythme respiratoire nous a semblé être avec les mouvements des yeux, l'index comportemental le plus fidèle de cette phase de sommeil. Les variations du rythme cardiaque sont moins constantes et ne s'observent que dans 70 % des cas environ. Le plus souvent il s'agit d'un ralentissement mais au cours d'une même nuit on peut observer soit un ralentissement, soit une accélération.
La durée de ces phases de sommeil, variable d'un sujet a l'autre, est en moyenne de 20 à 30 minutes et tend à devenir plus longue vers la fin de la nuit (fig. 12). Chez l'adulte leur durée totale représente 90 à 30 % de la durée totale du sommeil comportemental. Chez l'enfant au dessous de 3 ans, ces périodes constituent de 35 à 40 % de la durée totale du sommeil.
Au cours de cette phase de sommeil, le seuil d'éveil par stimulation auditive est très nettement augmenté par rapport aux autres stades. Il s'est révélé trois à quatre fois plus élevé en moyenne qu'au cours du stade II, une fois et demie ou deux fois plus élevé qu'au cours des stades III et IV (voir fig. 12).
Résultats des réveils provoqués chez l'adulte normal
Seuls les souvenirs très précis de rêves, pouvant être ra¢ontés et transcrits avec détails ont été retenus. Lorsque les sujets déclaraient avoir l'impression d'avoir "rêvé" sans pouvoir donner de description précise du contenu du rêve, les résultats étaient tenus pour négatifs.
Quarante-cinq réveils ont été provoqués pendant ou immédiatement après une période de mouvements rapides des yeux. Il y a eu 31 souvenirs de rêve (68 %). Par contre, sur 60 réveils provoqués au cours des stades I, II, III ou IV, il n'y eut que trois souvenirs de rêve (8%).
Investigations cliniques chez l'homme
Sujets présentant des atteintes pathologiques cérébrales
L'apparition de P.R.S. comportementales facilement décelables chez l'animal décortiqué ou mésencéphalique chronique, nous a conduit à nous demander si une telle phase de sommeil ne pouvait pas également être objectivée par une analyse polygraphique chez les malades dont les atteintes pathologiques cérébrales étaient comparables aux lésions expérimentales réalisées chez l'animal. C'est pourquoi nous avons poursuivi systématiquement l'étude E.E.G. du sommeil chez des sujets présentant des troubles de conscience prolongés. De tels malades qui sont de plus en plus fréquents actuellement, grâce aux techniques de réanimation qui permettent de dépasser le stade de coma aigu, constituent un champ investigation extrêmement précieux: leur aspect clinique demeure en effet relativement fixe pendant des mois et même des années. Lorsque cela est possible, des examens anatomo-pathologiques permettent de constater des lésions fixées qui peuvent alors être confrontées aux données E.E.G. et cliniques (fig. 13).
Vingt enregistrements polygraphiques (E.E.G., E.M.G., mouvements des yeux, E.K.G, respiration) d'une durée de 6 à 8 heures ont été effectués chez 12 sujets atteints de troubles prolongés de la conscience (de 6 mois à 5 ans) [26,35]. Nous n'insisterons ici que sur deux aspects de ces troubles particulièrement intéressants.
A) Syndrome de décortication.
Nous résumons ici une observation typique concernant unde ces cas :
- FE... Jean, 30 ans: traumatisme crânien grave le 12-11-1959. Coma profond immédiat. Trachéotomie pour troubles respiratoires le même jour. Evolution pendant 18 mois d'un état de décortication avec triple flexion aux membres supérieurs, réflexe de MAGNUS et KLEIJN, hyperextension des membres inférieurs. Absence de toute perceptivité (ne répond pas aux ordres verbaux ou écrits). Absence de réaction d'orientation au stimuli visuels. Tourne la tête du côté d'un stimulus sonore de forte intensité. Ce malade a été enregistré à plusieurs reprises. Tous ses tracés sont comparables.
Le tracé E.E.G. est constitué par une activité thêta microvoltée, monomorphe, à 7 c/s, prédominant au niveau des régions postérieures. Ce tracé est d'une monotonie frappante car il ne subit aucune variation malgré les diverses stimulations sensorielles. A aucun moment n'apparaît d'ondes lentes de haut voltage ou de fuseaux.
Chez ce malade, l'étude polygraphique révèle l'existence de deux états de vigilance (fig. 14 A, 14B):
a) Lors de l'état de veille comportementale (les yeux sont ouverts) il existe une très riche activité musculaire au niveau du biceps (hypertonie de décortication) ou au niveau du scalp et des muscles frontaux. De nombreux artéfacts musculaires créés par la présence de mâchonnement se surajoutent sur le tracé. On note également de très nombreux clignements des yeux et quelques mouvements spontanés des globes oculaires. La respiration est alors du type périodique, six phases respiratoires consécutives étant suivies d'une pose de 15 secondes. La veille comportementale est entrecoupée périodiquement, environ toutes les 20 minutes, par des périodes de sommeil comportemental avec fermeture des yeux, dont l'aspect polygraphique est totalement similaire à la P.R.S. Observée chez l'animal décortiqué:
b) Le tracé E.E.G. s'aplatit légèrement sans qu'il y ait variation de la fréquence. Il peut apparaître également de discrètes bouffées d'ondes lentes rythmiques à 3 c/s en dents de scie au niveau du vertex. On constate alors une disparition totale de toute activité E.M.G. des muscles enregistrés: disparition des artéfacts musculaires au niveau du scalp, et de l'activité E.M.G. au niveau du biceps. Il existe à ce moment-là des mouvements rapides des yeux qui ont une allure moins régulière, plus stéréotypée que chez l'individu normal. La respiration s'accélère, devient irrégulière et perd son caractère de respiration périodique, le rythme cardiaque selon les phases de sommeil s'accélère ou se ralentit. La longueur moyenne de ces périodes de sommeil était de 7 minutes et la durée totale occupait 20% du temps d'enregistrement. Au cours de ces périodes, le seuil d'éveil était très augmenté. Il était impossible de réveiller le malade même par de violentes stimulations auditives et il ne pouvait être réveillé que par des stimulations nociceptives. Enfin, ce sujet présentait au cours de l'état de veille des clonies faciales droites sans traduction électrique au niveau du scalp. Celles-ci disparaissaient totalement au cours du sommeil.
Les tracés obtenus chez 4 autres malades atteints de syndrome de décortication ont été similaires. La vérification anatomique a révélé l'existence de plages de nécrose et de dégénérescence de la substance blanche très importantes, intéressant les trois quarts antérieurs des hémisphères et réalisant un véritable état de décortication fonctionnelle interrompant les projections thalamo-corticales (fig. 13). Un tel aspect d'encéphalopathie traumatique est semblable à celui décrit par S. STRICH [40]. Il s'est ajouté des lésions directes du pallium au niveau des cornes d'Ammon et de la partie antérieure des lobes temporaux. Le tronc cérébral était intact, mis à part une dégénérescence des faisceaux pyramidaux.
b) Syndrome de décérébration.
Deux sujets ont présenté pendant 3 mois un syndrome cle décérébration post-traumatique avec attitude constante des membres supérieurs en hyper-extension, rotation en dedans et pronation, hyper-extension des membres inférieurs. Absence totale de perceptivité et une attitude comportementale d'éveil (yeux ouverts) presque permanente. Chez de tels malades, les examens polygraphiques ont révélé l'existence de phases d'ondes lentes discrètes associées à un sommeil comportemental pendant de courtes périodes. Par contre, il existait toujours une activité E.M.G. au niveau du triceps et il n'a été possible de mettre en évidence que des périodes extrêmement courtes (une à deux minutes) associant des mouvements des yeux à une disparition totale de 1'E.M.G. L'ensemble de ces périodes ne dépassait pas 2 % de la durée totale des enregistrements. La vérification anatomique a révélé l'existence de lésions hémorragiques et de ramollissements anciens au niveau de la F.R. pontique, mésencéphalique postérieure au niveau du noyau rouge, du brachium conjonctivum, associées à des lésions discrètes diffuses de la substance blanche hémisphérique.
Discussion
Notre discussion portera d'abord sur les différences et les similitudes entre la P.R.S. chez le Chat et la phase de sommeil avec M.R.Y. chez l'homme.
A) Différence E.E.G.
Elles sont de deux ordres:
1) L'activité E.E.G. corticale du Chat au cours de la P.R.S. est identique à celle observée au cours d'un éveil intense. Par contre, chez l'homme, le tracé E.E.G. de la phase de sommeil avec M.R.Y. est différent de celui observé au cours de l'état de vigilance maxima (réaction d'arrêt, d'attention).
Cependant, au cours de cette phase de sommeil, il apparaît souvent un rythme occipItal. similaire au rythme alpha qui est observé pendant l'éveil, lors de la fermeture des yeux.
2) Il n'existe pas chez le Chat d'ondes à 3 c/s en "dents de scie" au niveau du vertex au cours de la P.R.S., comme on en observe chez l'Homme. Mais les conditions d'enregistrement chez le Chat ne sont pas les mêmes que chez l'Homme dont on enregistre l'E.E.G. à travers le scalp, méthode qui ne permet pas de déceler avec précision l'origine cérébrale de telles ondes. Survenant presque toujours avant les mouvements des yeux et non pendant ceux-ci, leur origine ne peut être pour cette raison assimilée à un mécanisme identique à celui des "ondes lambda" recueillies au cours de l'état de veille au niveau du cortex occipItal. [14]. Elles semblent plutôt accompagner un mécanisme causal des M.R.Y. Il est alors possible qu'elles soient un reflet lointain de l'activité du système limbique ce qui expliquerait leur localisation E.E.G. élective au niveau du vertex (Gyrus Cingulé) et du lobe temporal chez l'homme. Elles seraient alors dans cette hypothèse, l'analogue de l'activité rythmique hippocampique observée chez l'animal.
De telles différences chez ces deux espèces, l'Homme et le Chat, n'impliquent pas forcément des mécanismes neuro-physiologiques différents. D'une part, elles peuvent s'expliquer par des conditions d'enregistrement non identiques (électrodes corticales chez le chat, électrodes sur le scalp chez l'homme). D'autre part, il est possible que seule l'organisation anatomique et fonctionelle du néocortex soit différente chez l'homme et chez le Chat, ce qui expliquerait que les tracés E.E.G. ne soient pas identiques, tandis que les structures et les mécanismes souscorticaux responsables de cette phase de sommeil seraient semblables, expliquant alors le faisceau de ressemblances étroites qui existent entre les phénomènes comportementaux observés chez ces deux espèces.
B) Similitude des phénomènes comportementaux (Tableau 1).
Les M.R.Y. observés chez l'homme ressemblent en tout point à ceux que le chat présente lors de la P.R.S. Ils évoquent les mouvements complexes de fixation d'objets lors de l'état de veille, survenant par bouffées plus ou moins longues, interrompus de brèves périodes d'immobilité. Ils s'accompagnent de mouvements des commissures labiales (mouvements des vibrisses et des oreilles chez le chat) et des extrémités des membres.
Les variations végétatives sont caractéristiques. Celles de la respiration sont analogues chez les deux espèces et constituent l'un des index les plus fidèle de la P.R.S. Les variations du rythme cardiaque sont moins constantes chez l'homme que chez le chat mais s'observent néanmoins au cours de 70 % des P.R.S. (à type de bradycardie le plus souvent).
TABLEAU I : Aspects polygraphiques de la P.R.S.
| Chat normal | Chat décortiqué | Homme normal | Syndrôme de décortication | |
| Activité rapide corticale | + | 0 | Rythme alpha | 0 |
| Activité thèta hippocampique | + | + | Ondes à 3 c/s en dents de scie | ? |
| Activité thêta et fuseaux pontiques | + | + | ? | ? |
| Seuil d'éveil | Très augmenté | Très augmenté | Très augmenté | Très augmenté |
| Disparition du tonus musculaire | + | + | Non décelable par l'E.M.G. | + |
| M.R.Y. | + | + | + | + |
| Variations végétatives Coeur et respiration |
+ | + | + | + |
| Equivalent subjectif | ? | ? | Rêve | ? |
La disparition du tonus musculaire (signalée par l'abolition de l'E.M.G. des muscles de la nuque chez le chat) avait été remarquée chez l'homme dès 1932 par KOURETAS et SKOURAS [28] au cours du cauchemar : ils observèrent pendant le sommeil d'un sujet de 25 ans une atonie subite et totale de tout le corps pendant les cauchemars, faisant place à une simple hypotonie pendant le reste du sommeil. Nous n'avons pas pu encore mettre en évidence cette atonie par la méthode E.M.G. chez l'homme normal, comme nous l'avons fait chez le chat. Les muscles de la nuque qui ont un rôle antigravifique chez le chat en posture de sommeil ne jouent aucun rôle chez l'homme couché à plat, la tête appuyée sur un oreiller (ce qui explique la disparition de toute activité E.M.G. dès que le sujet est étendu). L'étude du sommeil chez l'homme en position assise devrait permettre de résoudre cette question.
Par contre, lorsqu'une hypertonie apparaît chez l'homme et qu'une activité E.M.G. peut être enregistrée dans des conditions de repos, on assiste alors au cours de la phase avec M.R.Y. à une disparition totale de l'activité E.M.G.
Enfin, des réveils par stimulation auditive au cours du sommeil révèlent aussi bien chez le chat que chez l'homme une augmentation importante du seuil d'éveil pendant cette phase. Quelque soit l'explication neurophysiologique et la signification de la "profondeur" de cette période de sommeil, cet argument permet d'infirmer l'hypothèse assimilant cette phase chez l'homme au stade I, donc à un stade de "sommeil léger" [11, 12 39]. Il faut admettre au contraire qu'il s'agit d'une phase qualitativement différente survenant périodiquement au cours du sommeil [22].
C) Similitude structurale.
Chez l'homme, le hasard provoque des lésions pathologiques dont la localisation peut être comparée à celle de lésions expérimentalement réalisées chez l'animal.
Ainsi, chez des sujets présentant un syndrome de décortication, des phases de sommeil avec M.R.Y. ont pu être observées, identiques aux P.R.S. du chat décortiqué. Elles constituent alors la presque totalité du sommeil comportemental, et leur durée relative représente 20 à 25 % du cycle nycthéméral.
Des lésions du tronc cérébral inférieur chez l'homme suppriment l'apparition des phases de sommeil avec M.R.Y. Dans les cas que nous avons observé, les lésions étaient, il est vrai, diffuses et non limitées au noyau R.P.C.et débordaient un peu la F.R. mésencéphalique. Cependant, ce fait peut être comparé avec les résultats obtenus chez le chat après destruction du R.P.C.
D) Autres aspects fonctionnels.
A l'ensemble de ces données objectives on peut en ajouter d'autres (dont la valeur est plus limitée) qui pourraient trouver une application dans le domaine de la Psychiatrie.
Chez le chat, la suppression des P.R.S. (par lésion du noyau R.P.C.) entraîne l'apparition périodique de phénomènes évoquant des hallucinations, associées à des troubles végétatifs (tachycardie) [21].
Chez l'homme, des expériences de privation totale de sommeil ("sleep deprivation") [6, 7, 27 ,31] entraînent presque constamment l'apparition d'hallucinations somesthésiques, auditives et visuelles. DEMENT [10] a réalisé la privation élective de phases de sommeil avec M.R.Y. chez l'homme pendant 48 heures, mais un tel laps de temps a été insuffisant pour laisser apparaître des hallucinations.
Ainsi, une revue critique des différences et similitudes entre la P.R.S. chez le chat et le sommeil avec M.R.Y. chez l'homme permet d'admettre qu il existe une très grande probabilité pour que l'activité onirique survienne au cours d'un stade de sommeil analogue à la P.R.S. (alors qu il est impossible d'affirmer que le chat rêve au cours de la P.R.S. !).
L'actirité onirique apparaît ainsi comme l'équiralent subjectif des phénomènes cérébraux cérébraux survenant au cours de la P.R.S. : elle constitue un phénomène périodique lié étroitement aux modifications du tonus musculaire et du système végétatif (qui ne lui sont cependant pas liées de façon réciproque puisqu'ils apparaissent chez les sujets et animaux décortiqués). L'activité onirique dépendrait ainsi de la mise en jeu périodique au cours du sommeil d'un groupe de neurones situé au niveau de la F.R. Pontique, en rapport étroit avec le système limbique par des voies ascendantes distinctes du S.R.A.A.
Une analyse plus poussée des mécanismes et des fonctions du rêve est difficile à l'heure actuelle. Ce phénomène mystérieux qu'est le rêve soulève encore de nombreuses questions qui restent sans réponse.
Pourquoi la P.R.S., qui semble s'accompagner d'une activité unitaire corticale et réticulaire importante [15, 19] est-elle associée avec une disparition totale de toute activité E.M.G. ? Quelle est la fonction de cette phase associant "onirisme cérébral" et "sommeil musculaire" qui interrompt périodiquement la phase d'activité lente du sommeil dénuée semble-t-il de toute activité subjective et acconupagnée d'un certain état de vigilance musculaire ?
Comment expliquer que les mouvements des yeux observés chez l'homme normal au cours de la P.R.S. et dont la relation avec l'imagerie onirique semble très étroite [8,11,12] existent également chez des nourrissons, des aveugles, des sujets atteints d'un syndrome de décortication et "inconscients" depuis des années ? Il faudrait alors admettre que ces mouvements des yeux soient sous la dépendance primaire de centres sous-corticaux ou d'un contrôle limbique. De tels mouvements de balayage des yeux pourraient alors être la cause, et non la conséquence des processus centraux dont la mémorisation ultérieure se traduit si souvent par une imagerie irrationnelle.
Occupant le quart ou le tiers de nos nuits de sommeil, le rêve a éveillé notre curiosité de tout temps. Pour le neurophysiologiste la porte des rêves est à peine entrouverte et la clef des songes n'est pas encore découverte. Si certains mécanismes de l'activité onirique semblent se dévoiler, les fonctions du rêve nous demeurent toujours inconnues. Cependant, l'imagerie onirique qui étonne notre cerveau éveillé s'intègre à l'unité de l'organisme puisqu'elle est soumise, de même que les grandes régulations végétatives et homéostasiques, à l'activité d'un groupe cellulaire situé au sein de la F.R. Pontique.
Fig. 1A. - Chat intact - Eveil
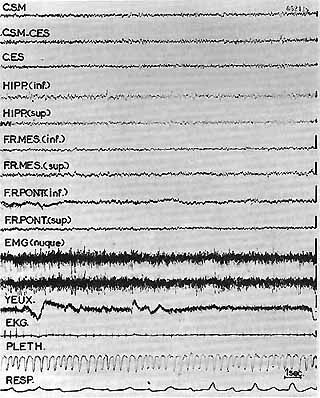
Activité rapide corticale et sous-corticale. L'activité de l'hippocampe ventraI (Hipp) est également rapide et il n'a jamais été enregistré d'activité thêta de veille chez cet animal. Activité E.M.G. importante au niveau de la nuque et des muscles frontaux où sont situées les électrodes oculaires.
Légende pour les figures: 1A - 1B - 1C
- C.S.M. - C.E.S.: cortex sensori-moteur, ectosylvien.
- Hipp. inf. sup.: dérivation successive entre les 3 pôles d'une électrode tripolaire située au niveau de l'hippocampe ventral au niveau suivant (A8 - L7 - HC - 6).
- F.R. Mes. (Inf. Sup.): dérivation successive entre les 3 pôles d'une électrode tripolaire située au niveau du tegmentum mésencéphalique (A2 - L2 - HC - 3).
- F.R. Pont. (Inf. Sup.): idem, Electrode située au niveau de la partie médiane du Noyau Reticularis Pontis Caudalis.
- L'activité E.M.G. de la nuque est recueillie par deux électrodes bipolaires fixées à demeure.
Calibrage 1 seconde - 50 microV
Figure 1B : Même animal. "Sommeil lent"
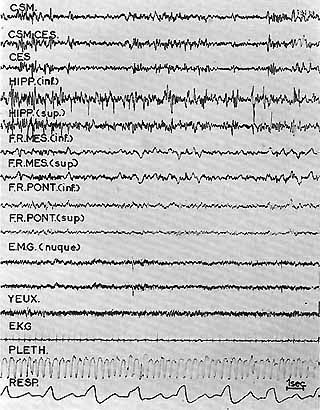
Activité de fuseaux et d'ondes lentes au niveau du cortex ct de la F. R. mésencéphalique. Activité de pointes de haut voltage au niveau de l'hippocampe. L'activité pontique varie peu avec l'état de veille. Diminution de l'activité E.M.G. de la nuque. L'activité E.M.G. au niveau du front varie peu (fermeture de l'orbiculaire). Augmentation legère de l'index pléthysmographique de la patte anterieure (Pleth.). Respiration ample et régulière. Le seuil d'éveil par stimulation réticulaire était de 1,5 volts au cours de ce stade.
Légende pour les figures: 1A - 1B - 1C
- C.S.M. - C.E.S.: cortex sensori-moteur, ectosylvien.
- Hipp. inf. sup.: dérivation successive entre les 3 pôles d'une électrode tripolaire située au niveau de l'hippocampe ventral au niveau suivant (A8 - L7 - HC - 6).
- F.R. Mes. (Inf. Sup.): dérivation successive entre les 3 pôles d'une électrode tripolaire située au niveau du tegmentum mésencéphalique (A2 - L2 - HC - 3).
- F.R. Pont. (Inf. Sup.): idem, Electrode située au niveau de la partie médiane du Noyau Reticularis Pontis Caudalis.
- L'activité E.M.G. de la nuque est recueillie par deux électrodes bipolaires fixées à demeure.
Calibrage 1 seconde - 50 microV
Fig. 1C. - Même animal. P.R.S. (2 minutes après 1 B)
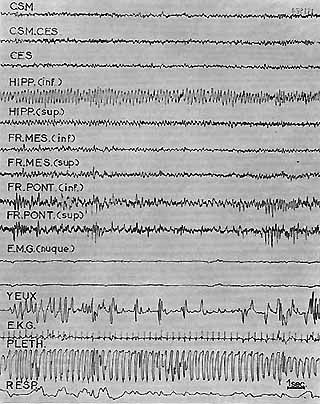
Activité corticale et mésencéphalique rapide similaire
à celle de l'éveil. Rythme thétahyppocampique à
5 c/s très régu]ier. Au niveau de la F. R . pontique, on
retrouve cette même activité rythmique associée à
quelques "fuseaux".
Disparition totale de l'activité E.M.G. de la nuque.
Très nombreux mouvements rapides des yeux.
Augmentation de l'index plethysmographique (au cours d'autres P.R.S. l'index
a au contraire diminué).
Irrégularité du rythme respiratoire qui est également
plus superficiel.
Seuil d'éveil comportemental au cours de ce stade: 4 volts.
Légende pour les figures: 1A - 1B - 1C
- C.S.M. - C.E.S.: cortex sensori-moteur, ectosylvien.
- Hipp. inf. sup.: dérivation successive entre les 3 pôles d'une électrode tripolaire située au niveau de l'hippocampe ventral au niveau suivant (A8 - L7 - HC - 6).
- F.R. Mes. (Inf. Sup.): dérivation successive entre les 3 pôles d'une électrode tripolaire située au niveau du tegmentum mésencéphalique (A2 - L2 - HC - 3).
- F.R. Pont. (Inf. Sup.): idem, Electrode située au niveau de la partie médiane du Noyau Reticularis Pontis Caudalis.
- L'activité E.M.G. de la nuque est recueillie par deux électrodes bipolaires fixées à demeure.
Calibrage 1 seconde - 50 microV
Fig. 2. - P.R.S chez un animal décortiqué
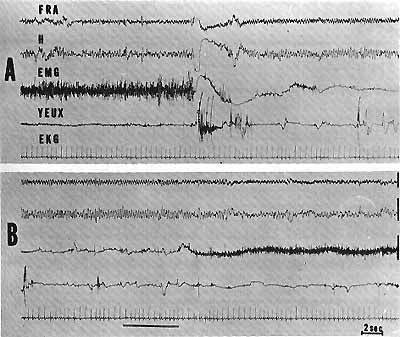
A : Apparition d'une activité thêta à 5 c/s au niveau de l'hippocampe ventral (H) en même temps que l'activité E.M.G. de la nuque disparait soudainement (chute de la tête) et qu'il apparaît des mouvements rapides des yeux. De tels mouvements sont relativement plus stéréotypés et moins fréquents que chez l'animal intact (comparés avec 1 C). On enregistre également une activité rythmique au niveau de la partie médiane de la F. R. mésencéphalique (F.R.A.)
B : 40 secondes après A. Un bruit violent (trait horizontal) entraîne le retour de l'éveil avec réapparition du muscle et disparition des mouvements des yeux.
Figure 3 : Coupe sagittale du tronc cérébral d'un chat mésencéphalique
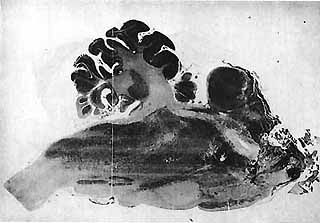
Toute la partie de l'encéphale située en avant du colliculus inférieur a été enlevée. Survie de 10 jours. Cette préparation a présenté des P.R.S. pendant 20 % du temps d'enregistrement.
Fig. 4. - P.R.S. chez un animal pontique
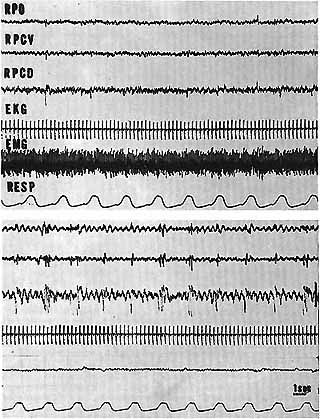
En haut: Etat de veille. Activité rapide et microvolté au niveau du noyau R.P. et R.P.C. Importante activité E.M.G. au niveau de la nuque (hypertonie de décerebration)
En bas: P.R.S. Activité rythmique à 3 c/s au niveau du tronc cérebral particulièrement nette au niveau des dérivations du noyau R.P.C. où il existe une activité paroxystique ressemblantant a des fuseaux. Disparition de l'activité E.M.G. Ralentissement cardiaque et accéleration respiratoire. R.P.C. V et D : dérivvation centrale et dorsale au niveau du noyau R.P.C.
Cal. 1 sec. 50 microvolts.
Fig. 5. - Lésion du noyau R.P.C.
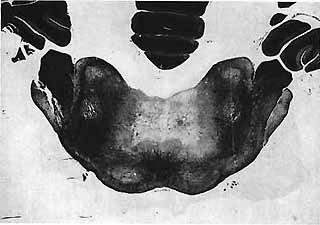
Cet animal a été sacrifié 2 mois après la lésion. Il n'a présenté aucune P.R.S., E.E.G. ou comportementale pendant 45 jours. Il existait un "comportement hallucinatoire" périodique lors de l'état de veille. Il y avait une activité rapide corticale au cours de l'éveil, des fuseaux et ondes lentes au cours du sommeil lent. Vers la fin du deuxième mois de courtes P.R.S. ont réapparu.
Figure 6 : Coagulation du Noyau Centralis Superior de Bechierew (Nissl)
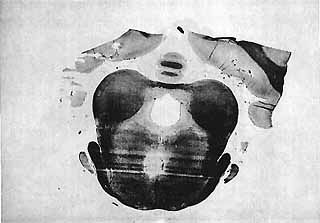
Cette lésion a supprimé l'activation corticale au cours de la P.R.S. pendant 5 jours. Ensuite, l'activité est redevenue rapide, mélangée à quelques fuseaux. Il n'y a jamais eu d'atteinte de l'activité corticale au cours de l'éveil ou du sommeil lent.
Fig. 7. - Destruction du Septum
Même résultat que pour la figure 6.
Fig. 8 - Absence d'activation corticale au cours de la P.R.S.
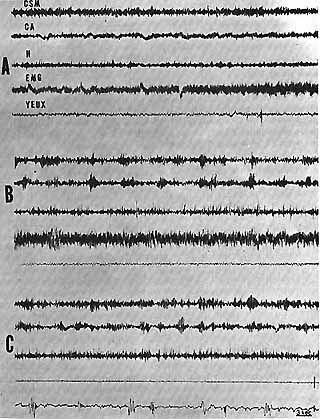
A : Eveil : activité rapide corticale (C.S.M.) (C.A.), hippocampique
(H.)
B : Sommeil lent : activité lente et fuseaux corticaux. Activité
de pointes hippocampiques.
C : "P.R.S." : il y a une discrète activation de l'activité
corticale, mais il persiste des fuseaux et il n'y a pas d'apparition d'activité
rythmique au niveau de l'hippocampe. Disparition totale de l'E.M.G. de
la nuque. Mouvements des yeux.
Cal. 3 sec. 50 microvolts.
Un tableau E.E.G. identique au cours de la P.R.S. s'observe après des lésions de la partie ventrale du mésencéphale et du septum.
D'après Jouvet, Arch. Ital. Biol. [21].
Fig. 9. - Représentation très schématique des structures responsables de la P.R.S.
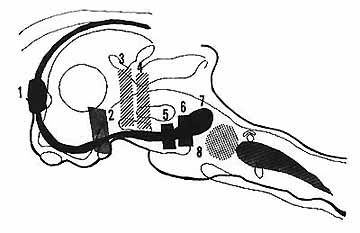
En pointillé (8) Noyau R.P C. dont la destruction supprime les aspects E.E.G. et comportementaux de la P.R.S. (fig 5).
En noir : Partie ascendante du Limbic Midbrain Circuit - avec en 7 la "Limbic Midbrain Area" de Nauta [33] -1,2,5,6 Région du septum (fig. 7), de la région sous thalamique, de la région du noyau interpédonculaire et de la partie médiane du tegmentum pontique antérieur (fig. 6). de telles lésions suppriment en tout ou en partie, l'activité rapide corticale et l'activité rythmique à 5 c/s hippocampique au cours de la P.R.S.
En hachure oblique : 3,4 lésion interrompant le système réticulé activateur ascendant au niveau du tegmentum mésencéphalique. De telles lésions qui suppriment l'Arousal Cortical, peuvent laisser persister une activité rapide corticale pendant la P.R.S.
En grisé : F. R. Ponto Bulbaire inhibitrice dont la mise en Jeu est probablement responsable des différents phénomènes végétatifs et de l'inhibition du tonus musculaire .
Fig. 10. - Aspects E.E.G. du sommeil chez l'homme normal
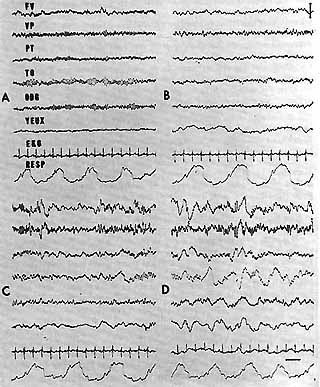
- A : Eveil: rythme alpha.
- B : Stade I . Disparition de l'alpha. Seuil d'éveil très bas, mouvements lents des yeux.
- C : Stade II . Fuseaux antérieur et ondes thêta.
- D : Stade III Fuseaux et activité delta diffuse recueillie également sur des électrodes oculaires.
Cal. 1 sec. 50 microvolts.
Fig. 11. - Aspects E.E.G. de la P.R.S. chez l'homme normal
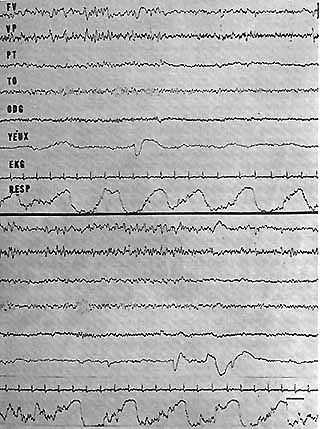
Tracés enregistrés chez le même sujet, au cours de deux P.R.S. successives la même nuit. Activité rvthmique à 3 c/s, en dents de scie au niveau du vertex. Dans les deux cas, cette activité précède les M.R.Y. En haut, le rythme alpha postérieur n'est aps bloqué par les M.R.Y., tandis qu'il disparaît en bas. Noter également l'irrégularité respiratoire.
Cal. 1 sec. 50 microvolts.
Figure 12 : Périodicité des P.R.S. et seuils d'éveil chez l'adulte normal
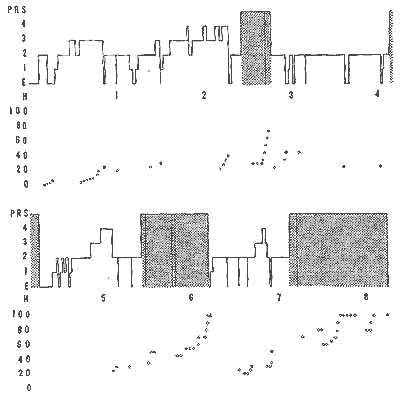
Représentation schématique d'un enregistrement de 8 heures de sommeil de nuit. Les deux tracés se font suite.
En haut : En ordonnée: Eveil (E) les 4 stades de sommeil et la P.R.S. (qui est figurée en pointillé); En abscisse : temps en heure (de 22 heures à 6 heures du matin). Les P.R.S ont occupé dans ce cas 28% du sommeil.
En bas : En ordonnée : intensité du stimulus sonore
(son à 1000 c/s), déclenché par un stimulateur
(échelle en volts);
Les points blancs représentent les stimulations qui n'entraînent
pas d'éveil;
Les points noirs les stimulations qui entraînent un éveil
sant souvenir de rêve;
Les triangles noirs, réveils et souvenir de rêve.
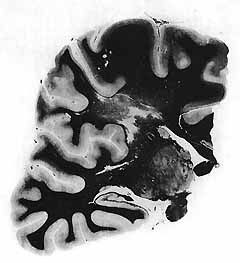
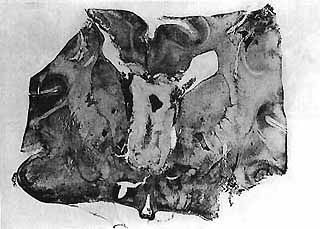
Encéphalopathie traumatique. Coupe frontale de l'hémisphère gauche (celloïdine-Woelcke). Vastes foyers de nécrose centrale et pâleur myelinique du centre oval réalisant un état de décortication fonctionnelle. Des lésions identiques existaient au niveau de l'hémisphère droit. Le tronc cérébral de ce malade était normal.
Figure 14 a : Coma traumatique prolongé - Syndrôme de décortication
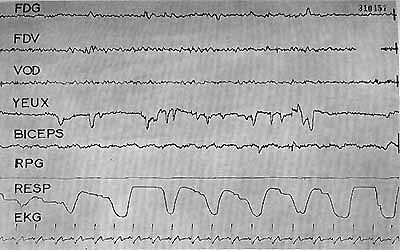
Etat de veille comportemental : yeux ouverts. Tracé E.E.G. presque complètement masqué par des artéfacts musculaires au niveau des régions frontales. Intense activité au niveau du biceps (hypertonie de décortication). Respiration de type périodique.
Cal 1 sec. 50 microvolts.
Figure 14 b : Même malade. Etat de sommeil comportemental
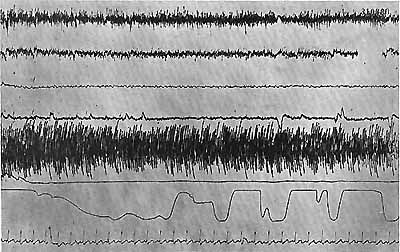
Yeux fermés avec M.R.Y.; Discrètes ondes lentes à 3 c/s au niveau du vertex; Mouvements des yeux; Disparition totale de l'activité E.M.G.; Accélération respiratoire; Ralentissement cardiaque.
Cal 1 sec. 50 microvolts.